























钙的性质
1.钙的物理性质 钙也是一种银白色的轻金属,它的熔点是848C,硬度比镁稍大,
2.钙的化学性质 钙的化学性质和镁相似,但活动性比镁更强,这从下面的一些事实可以说明,
(1) 钙比镁更容易被氧化,钙露置在空气里,表面上很快就蒙上一层松脆的氧化钙.这层氧化物很疏松,对内部的金属不能起保护作用,所以钙必须保存在密闭的容器里,钙在空气里加热时,也能燃烧,并放出大量的热,火焰呈砖红色同时也有少量氮化钙(Ca3N2)生成:
(2)钙跟卤素、硫、氮等非金属元素化合都比镁容易。钙还能跟磷直接化合生成磷化钙:
3Ca+2P= Ca3P2
(3)钙跟水的反应比镇跟水的反应要剧烈,钙在冷水里就能起猛烈反应,生成包氧化钙并放出氢气:
.jpg)
钙在自然界里的存在,钙的冶炼和用途 钙在自然界里也都以化合态存在,它不仅分布很广,而且含量很大,地壳中钙的含量占第五位(3.25%).分布最广的钙的化合物是碳酸钙(CaCO3),石灰石、白垩、大理石等是不纯的碳酸钙,方解石和冰洲石则是比较纯净的碳酿钙.此外如石膏(CaSO4.2H2O)、萤石(CaF2)、磷灰石以及纤核磷灰石等,也都是钙的
矿物。
钙的化合物也存在于土壤里和动植物有机体里,动物骨骼的主要成分是磷酸钙.
钙也是植物的营养元素之一,
工业上用电解熔融的氯化钙来冶炼钙.电解时阴极上析
出金属钙:
CaCl2 <==> Ca+++2C1-
钙主要用来制造合金,含有1%钙的铅合金,是一种重要的轴承材料,
钙的化合物
1.氧化钙(CaO)氧化钙俗名叫生石灰,或简称石灰是一种白色固体,它由碳酸钙强热分解而得:
工业上用石灰石在容内煅烧,大量生产生石灰。
氧化钙极易限水起反应(叫做石灰的消化或熟化),生成氢氧化钙:
CaO+H2O= Ca(OH)2
石灰消化时放出大量的热,因此有大量水燕气逸出,生成的氢氧化钙是白色粉末状固体,石灰消化后体积增大很多,因此在运输石灰时,要防止被雨淋湿或着水,否则会引起船只或其他运输工具着火燃烧或损坏。
由于石灰易跟水化合,有很强的吸湿性,因此可用作干燥剂.
2.氢氧化钙[Ca(OH)2] 氢氧化钙又叫消石灰或熟石灰它是一种白色粉末状固体,在水中的容解度不大,但比氢氧化镇大些。把氢氧化钙放在水里,搅动后得到一种乳白色的液体,这是氢氧化钙的颗粒在石灰水里生成的悬浊液,叫做石灰乳。石灰乳静置若干时后,悬浮的颗社会逐渐下沉,上部澄清的液体是氢氧化钙的饱和溶液,叫做石灰水,
氢氧化钙是中等强度的破,它在水溶液里能电离生成钙离子和氢氧根离子:
Ca(OH)2===== Ca+++2OH-
但由于氢氧化钙的溶解度不大,因此溶液里电商生成的OH-离子的被度不可能很大,它的碱性要比氢氧化钠和氢氧化钾弱得多。
氢氧化钙具有一切可溶性碱的通性,它容易跟二氧化碳(酸性氧化物)发生反应,生成碳酸钙沉淀,使澄清的石灰水变
得浑浊:
Ca(OH)2+CO2= CaCO3↓+H2O
或
Ca+++2OH-+CO2= CaCO3↓+H2O.
这个反应通常用来检验二氧化碳气体.由于空气里含有二氧化碳,因此盛石灰水的试剂瓶用毕后,必须立即把塞子盖紧,
生石灰和消石灰是重要的建筑材料,消石灰、砂和水的混和物称做“三合土”,在建筑上用来粘合砖石,三合土粘合
砖石后,在空气里它一方面渐渐失去水分,一方面吸收空气中的二氧化碳,使消石灰变成碳酸钙品体而结成硬块,搀入砂
可以增加硬度并使结成的硬块变成多孔性,以增加结合的坚固性。
生石灰和消石灰也是农业上常用的“石灰肥料”。石灰肥料虽不能直接供给植物以营养元素,但它能降低酸性土壤的
酸性,并能改进土壤的结构和增高土壤的肥力,它还能促使某些微生物的繁殖,加速土壤里含氮有机物的分解,成为易被
植物吸收的养料,在施用石灰肥料时,应该注意不和氨态氮肥同时使用,因为复态氮肥遇到消石灰时,容易生成氨气而
逸散到空气里去,从而使所用的氮肥失去肥效。
生石灰和消石灰还可以用来防治农作物的病虫害,配多尔多液和石灰硫黄合剂等。
3.碳化钙 (CaC2) 碳化钙俗称“电石”。工业上用焦炭在电炉(3000层)荔还原生石灰而制得:

纯粹的眼化钙应为无色透明的随体,工业上用的“电石”因含有杂质,一般是暗灰色的粗松坚硬物质,碳化钙遇水立即发生反应,生成乙块(俗名“电石气”)和氢氧化钙:
CAC2+2H2O=C2H2↑+CA(OH)2
碳化钙是一种重要的工业原料。
4.钙盐
(1)碳酸钙(CaCO).碳股钙是自然界里分布最广的一种碳酸盐.纯净的碳酸钙是一种白色粉求状的物质,它的性质和碳酸镁十分相似.碳酸钙不溶于水,但如果水中已溶有多量的二氧化碳,则能使之溶解,生成可溶性的碳酸氢钙:
CaCOg3+H2O+CO2 = Ca(HCO3)2
天然产的碳酸钙如石灰石、大理石和白垩等是重要的建.石灰石可用作炼铁时的熔剂以及制造生石灰、二氧化碳、玻璃等,在辗米时加入少磨细的石灰石粉末可以防止米粒的破裂.
(2) 硫酸钙(CaSO4).石膏是天然产的含有2个分子结晶的硫酸钙(CaSO4.2H2O).把石膏煅烧到180C,就失去结晶水的3/4而成烧石膏[(CaSO4).2H2O].烧石膏能跟水重新变成石膏,很快硬化,体积并稍稍膨胀:
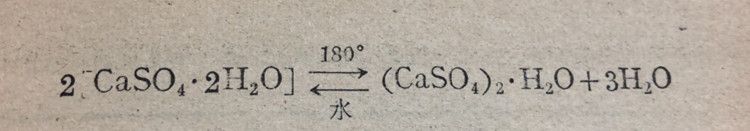
因此烧石膏可以用来塑石膏像、制石膏模型和在外科上用作固定绷带等.
如果把石膏加热到200C以上,它将失去全部结晶水而成无水硫酸钙,称做“过烧石膏”或“焦石膏”,它不能再吸水而
硬化,因此不能用来塑像或制其它模型。