用叠氮化鈉和碘的試驗法
一个含叠氮化鈉(NaN3)及碘(以KI3形态)的水溶液,即使放置良久,并不显示变化。可是一经加入二硫化碳,立即发生反应,猛烈地释出氮并耗去了碘:
2NaN3+I2 → 2NaI+3N2 (1)
二硫化碳似不参与这个反应,而作用如一催化剂。这个催化作用表面上都和无机硫代化合物及含C=S及C-SH基团有机化合物的试驗法相类似.
二硫化碳在碘-叠氮化鈉反应上的作用,是由于一种典型中间反应的催化作用。叠氮化鈉和二硫化碳形成叠氮二硫代碳酸CS(SH)N3的鈉盐,如反应式(2)所示。接着是氧化还原反应(3),通过这反应,二硫化碳再生了,重复投入反应(2)。快速的中間反应(2)与(3)之和,即是反应(1),其中催化活性的CS2不复出現:
2NaN3+2CS2 ⇋2CS(SNa)N3 (2)
2CS(SNa)N3+I2 → 2CS2+2NaI+3N2 (3)
因此,二硫化碳就可通过氮的释出,或碘-叠氮化鈉混合物颜色的消失来作出檢定。硫醇类及硫酮类的性行和二硫化碳相似。
操作手续 在有机液体例如酒精中,二硫化碳的試验可在表面皿上将試液一滴与試剂一滴混和来进行,注視氮气泡的发出。如有消耗碘的物料(硫化氢等)存在,試液必须预先用溶在碘化钾或酒精中的碘数滴处理,直至碘的颜色不复褪失,然后才可加入叠氮化钠-碘的混合物。
二硫化碳的试验法也可用类似于试验硫化物的方法来代替进行。在这方法中,如有必要,可先用碘处理試液,再用铂丝的线圈,移取試液一滴,使和悬于毛細管的碘-叠氢化钠溶液一滴接触,則可看出形成氮的气泡在毛细管内上升。
试剂:叠氮化钠3克溶于100毫升0.1N碘溶液中。
鉴定限度:0.14微克 二硫化碳
用甲醛及亚铅酸盐溶液的試驗法
二硫化碳用碱金屬氫氧化物处理,可轉化成三硫碳酸盐:
3CS2+6KOH → 2K2CS3+K2CO3+3H2O
这个三硫碳酸盐可和重金屬反应,产生不溶的盐类,这些盐很易被分解而形成硫化物。
相当量的二硫化碳在用濃苛性碱及亚鉛酸盐溶液处理时,将迅速轉化为硫化鉛。可是这对小量的二硫化碳不适用。三硫碳酸盐的形成与因此而产生硫化鉛,可用甲醛使之加速,其原因未明。乙醛、苯甲醛、阿拉伯糖、葡萄糖及乳糖都显示同样的效应。这个作用可提供一个檢定小量二硫化碳的方法。
操作手续 取試液一滴,放在滴试板上,加入40%甲醛溶液2或3滴,然后再攪拌加入浓碱性的亚鉛酸盐溶液一滴。視二硫化碳存在量的多少,将会形成黑色沉淀或棕至黑的颜色。
鉴定限度:3.5微克 二硫化碳
有硫化氢存在时,这个試驗法不能无修改地用来检定二硫化碳,因此时硫化鉛的形成,并不是二硫化碳专有的特性了。硫化氢可因加入溴水使之破坏:
H2S+4Br2+4H2O → H2SO4+8HBr
过量的溴可加入磺基水楊酸直至颜色褪失以除去之。
Br2+C6H3(OH)(COOH)(SO3H) → C6H2Br(OH)(COOH)(SO3H)+HBr
操作手续 在滴试板上,将浓溴水一滴一滴地加入,以处理試液一滴,直至有黄色不消失而止。加入固体磺基水杨酸使溶液褪色。然后再加入40%甲醛溶液2或3滴,接着加入亚铅酸盐的浓碱性溶液一滴,搅拌混合物。如有二硫化碳存在,将现出黑色沉淀或由黑至棕的颜色。
鉴定限度:10微克 二硫化碳
形成二甲基氨荒酸銅的檢定法
二硫化碳和脂族伯胺类反应,产生水溶的各别胺类氨荒酸盐。这些产物产生水不溶的黄-棕色銅盐,它們在苯、氯仿或乙醚等中的溶液,具有同样的颜色。有色溶液亦可从各组份直接得到。例如将飽和了二硫化碳的水(0.2%CS2)加到含二甲胺的銅氨溶液中,并用苯萃取,立即产生黄色的苯层。如将藍色的銅溶液和二硫化碳的苯溶液摇蕩,也可得到同样的效果,其反应为:
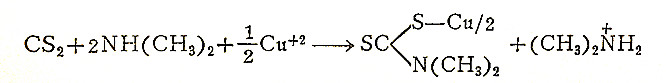
根据这个反应的試驗法,对二硫化碳以及用酸处理时分裂出二硫化碳的化合物(如黄原酸盐、三硫碳酸盐),都是有特征的。
操作手续 本試驗在一微量試管内进行。待試二硫化碳的液体(苯、氯仿等)一滴,用蓝色試剂溶液一或两滴处理,必要时,用苯一或两滴摇荡之。如有二硫化碳存在,苯层中将出現黄-棕至淡黄色。
試剂:0.2%硫酸銅溶液9毫升,用浓氨1毫升及盐酸二甲胺0.5克处理。这个試剂溶液可保持不变。
鉴定限度:3微克 二硫化碳