






有机试剂的结构并不是平面地展开的,实际上是按一定规律立体地排列着.另一方面,每个金属阳离子也都有着各自所特有的几组正常的或是杂化了的电子结构,并在一定范围内每种结构都可以沿着角和轴心发生变形,只是各种不同金属离子具有不相同的构型,且其可能发生的变形程度亦不同.因此,各种离子均具有与其他阳离子有所区别的结构特点,这便是不同金属离子所具有的共性之中的个性,即其特殊性的表现.因此,当金属离子与有机试剂反应时,金属离子在按一定规律排列,占据着各种空间位置的有机试剂分子相互作用而形成的螯合物分子中,只有当金属离子与试剂分子的各个起配位基团在结构上经一定的变形后使整个体系在反应条件下,无论在几何位置上和能量上均处于最有利的能量状态时,螯合作用的倾向才能达到最大,形成的螯合物结构也才是稳定的.相反,则螯合物或不能形成,或是即使能形成也极不稳定.
如上所述,一旦当有机试剂的组成或结构变化时,则它的各个配位基无论空间方向或者强度大小均发生变化,因而在反应条件下对于金属离子的要求亦有所改变,只有能充分适应这种变化了的结构要求的金属离子才能与这种有机试剂发生螯合,生成的螯合物才是稳定的.那么,各种金属离子所表现的各种价键又是以怎样的角度配布的呢?这应该分成两种情况来讨论:对于基本上是离子型的化合物来说,则有机试剂分子中的各个配位基团均必然带负电,被此间相互排斥,必须处在相互间尽可能远的位置上.这样,如是四合螯合物的话,则四个配位基必然占据在金属离子周围四面体的各个顶点上.若是六合结构,那么各个带负电顶点便呈八面体的形状排列;对于基本上是共价键的化合物来说,各个配位基的分布则取决于金属离子中用以成键的电子轨道的配布角度,同时,所形成的键的稳定性也与其他轨道的性质有关,一般来说,轨道位置愈深远,则形成的键也就愈稳定.例如,具有未被占据的d轨道的过渡元素要比其他金属离子易形成较稳定的键.参与成键的电子轨道的性质,除了与键的稳定性有关外,同样还决定了螯合物的立体结构,而常见的金属离子成键轨道的组合及键的相对稳定性和螯合物的构型如表Ⅹ-1.而不同构型的金属离子所呈的价键的取向如图Ⅹ-1.
表Ⅹ-1 轨道性质与键的相对稳定性及螯合物的构型
| 参与成键的电子轨道 | 配位数 | 键的相对稳定性 | 构型 |
| sp3 | 4 | 2.00 | 四面体 |
| dsp2 | 4 | 2.69 | 平面正方形 |
| d2sp3 | 6 | 2.93 | 八面体 |
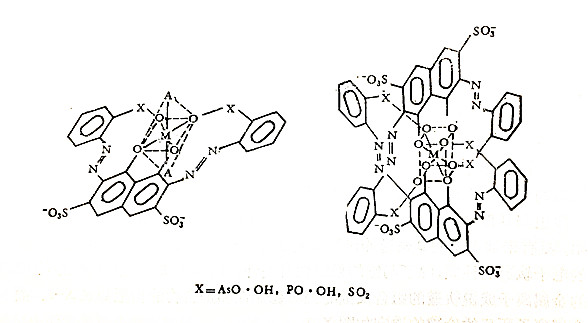
不同金属离子用以成键的电子轨道以及价键的配布角度的不同是由其离子性质决定的.具体地说是与离子最外层电子数及电子轨道空缺情况所决定的.例如最外层d轨道被10个电子充满着的Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)等离子,只能有sp3轨道可容纳配位体,所以它们的共价配位数是4,呈四面体构型.而轨道未被全部充满,能空出一个d轨道而组成dsp2轨道的话,由于它比sp3有较强的成键能力,则这类离子易生成共价配位数为4的平面正方形螯合物,Cu(Ⅱ)、Ag(Ⅱ)、Au(Ⅲ)及Ni(Ⅱ)、Pd(Ⅱ)、Pt(Ⅱ)等离子便是如此.当d轨道有较多的空缺时,则呈d2sp3螯合物,许多过渡金属元素的螯合物便是如此.例如,偶氮胂(Ⅲ)及其类似物与某些金属离子形成的1:1或1:2螯合物的结构如下.
研究金属离子价键的取向和构型对于深入了解金属螯合物的性质来说是有意义的,部分元素共价键的取向及其在周期表中的位置如表Ⅹ-2.
我们曾经讲过关于有机试剂的位阻和空间阻碍问题,现在再来讨论此问题时则可比较容易明确了.例如乙酰丙酮能与铜离子生成典型的螯合物,在pH4-10时,被乙酰丙酮-苯溶剂所萃取的铜约达90%,通过多次萃取,可以将铜定量分离完全.然而有人发现,当乙酰丙酮分子中的3位上有一个异丙基或仲丁基引入时,这种试剂的衍生物则不能与铜生成有色螯合物,这显然是由于大体积的取代基的引入破坏了螯合物的平面构型,从而妨碍了金属离子与配位基团之间双方相互满足各自构型所规定的几何上和能量上的要求,螯合作用的倾向则大大减弱,以致稳定的螯合物已不能生成.
相反,如果我们利用金属离子构型上的特点,根据提高螯合剂骨架的强度(如引进芳核、环化、交叉接合等),用空间效应来阻碍个别环的自由转动,选择配位基的特殊几何位置以及在螯合系统中引进带有过高或过低的电子密度的配位基团等方法,来限制螯合物构型的变化程度,则可期望具有这类特殊构型的多配位基试剂能表现出高度的选择性.