





1.无机沉淀剂
通常,平常无机沉淀剂为酸,例如盐酸、硫酸、硫化氢;氨的水溶液、过氧化氢和原则上属于氨的盐。
选择其中的一种作为沉淀剂的各样考虑中,最重要的是残留在沉淀中的过量沉淀剂是否具有挥发性。显然,在大多数情况下,铵盐比钠或钾盐有利。
许多金属离子与有机沉淀剂形成螯合物沉淀和缔合物沉淀。因此,有机沉淀剂可分为生成螯合物的沉淀剂和生成离子缔合物的沉淀剂两种类型。
(1)生成螯合物的沉淀剂作为螯合剂的沉淀剂至少具有两种官能团:一种为一个可取代的氢离子,即为一酸性官能团,如
-COOH、-OH、=NOH、-SH、和-SO3H
等;另一种是碱性官能团,即在分子中有一个未结合的电子对,如-NH2、-NH-、=N-、>C=O等。
满足这些要求的最简单化合物是甘氨酸(glycine)
氮有五个外売电子,它们只有三个用来与一个碳原子和两个氢原子化合,留下一对未结合的电子。在碱性条件下,甘氨酸失去它的一个氢,留下甘氨酸盐阴离子,后者与Cu(Ⅱ)反应如下:
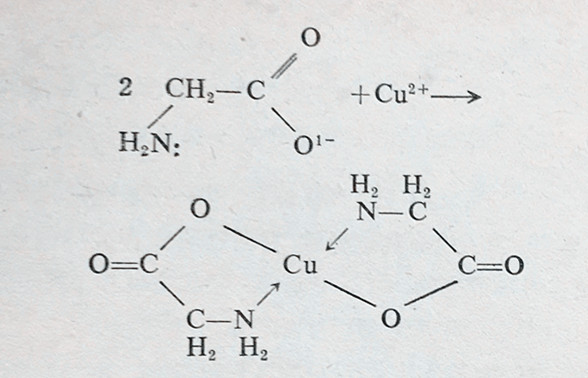
有机沉淀剂与金属离子形成的环最好是五员或六员环,这种排列在分子中产生最小的张力,张力越低,化合物越稳定。
(2)生成缔合物沉淀剂某些有机沉淀剂在水溶液中能够电离出大体积的离子,这种离子与金属离子结合成溶解度很小的缩合物沉淀。例如,氯化四苯胂(C6H5)4AsCl在水溶液中以(C6H5)4As+及Cl-形式存在,当溶液中含有某些金属含氧酸根或金属络阴离子时,体积庞大的有机阳离子与之结合,析出离子缔合物沉淀:
(C6H5)4As++MnO4- ⇌ (C6H5)4As·MnO4↓
(C6H5)4As++MgCl42- ⇌ [(C6H5)4As]2·HgCl4↓
又如四苯硼酸阴离子与K+反应,
K++B(C6H5)4- ⇌ KB(C6H5)4↓
KB(C6H5)4的溶解度很小,组成恒定,烘干后可以直接称量,所以NaB(C6H5)4是测定K+的较好有机沉淀剂。
许多有机沉淀剂能与多种金属离子络合,为了提高这些有机沉淀剂的选择性,往往可以通过调整溶液的pH,或改变沉淀剂的结构,或采用适当的掩蔽剂,从而达到便于分离的目的。例如,8-羟基喹啉在弱酸性或弱碱性溶液中(pH=3-9),能与多种金属离子发生沉淀反应,它与Al3+的反应为:
生成的沉淀恒定,可在烘干后直接称量。但8-羟基喹啉最大的缺点是选择性较差。为了提高其选择性,目前已研究合成一些选择性较好的8-羟基喹咻衍生物,如2-甲基-8-羟基喹啉在pH=5.5时沉淀Zn2+,在pH=9时沉淀Mg2+;Al3+不发生干扰。
又如苦杏仁酸是沉淀Zr(Ⅳ)的良好沉淀剂,在2MHCl溶液中,ZrO2+与苦杏仁酸产生白色沉淀,反应式如下:
此反应选择性高,一次沉淀就可将错与铁、铝、铬、钛、钒和铜等分离。但它的缺点是沉淀的溶解度较大。如果利用加重效应,适当改变其结构,可以克服这个缺点。实验证明,如果用对-溴苦杏仁酸或对-氯苦杏仁酸作为Zr(Ⅳ)的沉淀剂,则Zr(Ⅳ)沉淀得更完全,并可对少量Zr进行测定。