离子键
电负性值较小的活泼金属(如Na、K等)与电负性值较大的活泼非金属(如F、Cl等)元素的原子相互靠近时,活泼金属原子容易失去电子形成正离子,而活泼非金属元素原子易于得到电子形成负离子,正、负离子依靠静电引力结合在一起,构成成离子型化合物。这种正、负离子之间依靠静电引力形成的化学键叫做离子键。显然,离子键中正、负离子分别是键的正、负极,所以离子键是极性键。通常认为,电负性差值△X>1.7的两个金属与非金属元素间易于形成离子键。
离子键的本质是静电引力,由静电引力f=k[(q+·q-)(r++r-)]可知,离子电荷q+和q-越高,正、负离子核间距越小,引力越大,形成的离子键越强。
离子型化合物通常被认为是正、负离子(电荷是球形分布的)按照一定规则紧密堆积而成,每个离子可与很多异号离子之间产生相互吸引,只是由于距离的远近吸引力的大小不同而已;又因为离子电荷分布是球形对称的,所以每个离子可在任何方向上与异号离子产生吸引作用,因此离子键无方向性和饱和性。
.jpg) 与
与.jpg)
金属键
金属键的理论主要有两种:自由电子理论和能带理论。
自由电子理论
金属键自由电子理论认为,在固体金属中,金属原子释放出价电子而成为正离子,释放出的价电子可脱离原子,在整个晶格中自由运动,正是这些自由流动的价电子把许多金属原子和离子黏合在一起,形成金属键。金属键属于离域键,对于金属键,有一个形象的说法是:“金属离子浸没在电子的海洋中”。金属键既无方向性,也无饱和性。
自由电子的存在使金属具有良好的导电性和导热性。自由电子可以吸收可见光,然后又把大部分光反射出来,因而一般金属具有银白色光泽。自由电子在外电场的作用下定向流动形成电流。做热振动的金属阳离子对自由电子的流动产生阻碍作用,构成金属的电阻,且随着温度的升高,金属阳离子的热振动加剧,对电子运动阻力加大,导致金属的电阻一般随着温度的升高而加大。自由电子的运动可以把热能传递给邻近的原子或离子,从而很快使金属整体的温度均一化。
能带理论
在分子轨道理论的基础之上来讨论金属键的特性,形成了能带理论。
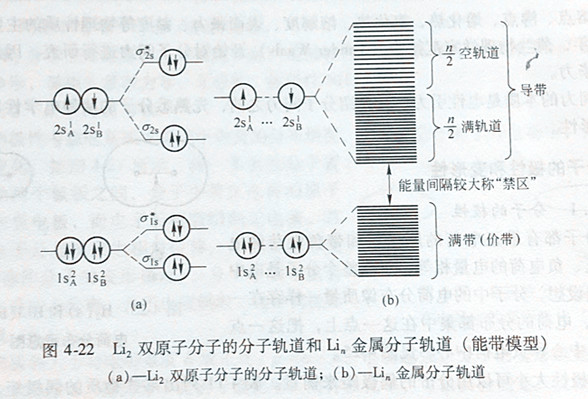
以金属Li为例。Li原子的核外电子排布为1s22s1,按照分子轨道理论,2个Li原子相互作用,形成Li2分子轨道:(σ1s)2(σ*1s)2(σ2s)2,见图4-22。
在金属Li中,n个Li原子共同成键,由于晶格结点上不同距离的Li核对电子有不同程度的作用力,导致电子能级发生分裂,能级差很小,形成一个几乎连成一片且有一定上、下的能级,这就是能带。在金属Li中,由n个1s轨道构成的能带,全部充满电子,称为满带。由n个2s轨道构成成的能带,电子仅为为半充满,其中n/2个σ2s轨道均占满电子,另外n/2个σ*2s轨道全空,电子很容易从σ2s轨道跃迁到σ*2s轨道,使i具有良好的导电性能,这种由未充满电子的原子轨道所形成的较高能量的能带叫做导带。在满带和导带之间,是电子的禁止区,称为禁带,电子不易跨越禁带从满带进入导带。不同的金属,由于构成它的原子核外电子分布各不相同,会形成其特有的能带。例如图4-23,金属Mg的3s能带(满带)与3p能带(空带)部分重叠,禁带消失,构成一个未满的导带,使得Mg具有导电性。由此看来,只要存在导带,在外电场作用下会形成电子定向流动,使材料呈导电性。
根据能带结构中禁带宽度和能带中电子填充情况,可把物质分为导体、绝缘体和半导体(图4-24)。固体材料中全空的导带称为空带。一般金属导体的导带是未充满的。绝缘体的满带与空带之间的禁带很宽,其能量间隔隔△E超过3eV(0.48×10-18J),电子难以借热运动跃过禁带进入空带,例如金刚石为绝缘体,其禁带宽达5.3eV。当禁带宽度在1eV左右时,便属于半导体,例如Si和Ge均为半导体,他们的禁带宽度分别为1.12eV和0.67eV。
