









根据原子轨道重叠方式的不同,可以把共价键分为两大类:σ键和π键。
σ键:原子轨道沿着核间连线的方向以“头碰头”的方式进行重叠,重叠部分相对于键轴(核间连线)具有圆柱形对称性。例如:两个H原子的1s轨道重叠形成H2分子;一个H原子的1s电子与一个Cl原子3p电子形成HCl分子;两个Cl原子的3p电子形成Cl2分子,见图4-12(a)
π键:原子轨道在核间连线的两侧以“肩并肩”的方式进行重叠,重叠部分相对于键轴所在的某一特定平面具有反对称性(即形状相同,符号相反)。例如:乙烯CH2=CH2分子中两个C的2p电子形成一个π键,见图4-12(b)。
.jpg)
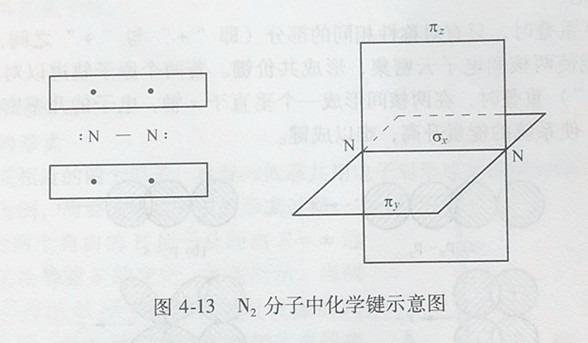
通常共价单键由σ键组成,双键由一个σ键和一个π键构成,三重键由一个σ键和两个π键构成。例如N2分子内N原子之间就有1个σ键和2个π键。N原子的价层电子构型为2s22p3,每个N原子2p轨道上有3个单电子,这3个2p电子分别分布在3个互相垂直的2px、2py、2pz轨道内,当2个N原子的px轨道沿着x轴方向以“头碰头”的方式重叠形成σ键时,2个N原子将进一步靠近,这时垂直于x轴的2py和2pz轨道也分别以“肩并肩”的方式重叠,形成两个π键。图4-13即为N2分子中化学键示意图。
还有一类特殊的共价键,它的共用电子对是由一个原子单方面提供,另一个原子提供空轨道,这一类共价键称作配位共价键,简称配位键。常用“→”表示配位键,箭头的方向是由提供电子对的原子指向接受电子对的原子。例如CO分子结构式为C=←O。在配合物中,形成体与配体之间的键均为配位键。
相关文章
共价键的类型https://www.999gou.cn/article.php?id=690
配位共价键是什么https://www.999gou.cn/article.php?id=333
离子键和共价键的提出和几种其他类型的微粒间的相互作用https://www.999gou.cn/article.php?id=2946
化学键中的共价键https://www.999gou.cn/article.php?id=1650
共价键的形成与价键理论要点https://www.999gou.cn/article.php?id=688
不同原子间的共价键有哪些https://www.999gou.cn/article.php?id=330
共价键的性质https://www.999gou.cn/article.php?id=4602
补充资料:
按成键方式
σ键
由两个原子轨道沿轨道对称轴方向相互重叠导致电子在核间出现概率增大而形成的共价键,叫做σ键,可以简记为“头碰头”。σ键属于定域键,它可以是一般共价键,也可以是配位共价键。一般的单键都是σ键。原子轨道发生杂化后形成的共价键也是σ键。由于σ键是沿轨道对称轴方向形成的,轨道间重叠程度大,所以,通常σ键的键能比较大,不易断裂,而且,由于有效重叠只有一次,所以两个原子间至多只能形成一条σ键。
π键
成键原子的未杂化p轨道,通过平行、侧面重叠而形成的共价键,叫做π键,可简记为“肩并肩”。π键与σ键不同,它的成键轨道必须是未成对的p轨道。π键性质各异,有两中心,两电子的定域键,也可以是共轭Π键和反馈Π键。两个原子间可以形成最多2条π键,例如,碳碳双键中,存在一条σ键,一条π键,而碳碳三键中,存在一条σ键,两条π键。
δ键
由两个d轨道四重交盖而形成的共价键称为δ键,可简记为“面对面”。δ键只有两个节面(电子云密度为零的平面)。从键轴看去,δ键的轨道对称性与d轨道的没有区别,而希腊字母δ也正来源于d轨道。
按成键过程
1、一般共价键
一般共价键有时也称“正常共价键”,是为了和“配位共价键”进行区分时使用的概念,指成键时两个原子各自提供一个未成对电子形成的共价键。
2、配位共价键
配位共价键简称“配位键”是指两原子的成键电子全部由一个原子提供所形成的共价键,其中,提供所有成键电子的称“配位体(简称配体)”、提供空轨道接纳电子的称“受体”。
按成键电子偏向
1、极性共价键
在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,电子云偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。这样的共价键叫做极性共价键,简称极性键。形成共价键时,由于电子云的偏离程度不同,极性键又有“强极性键”和“弱极性键”之分,但通常两个不同原子间的成键就是极性键。
2、非极性共价键
由同种元素的原子间形成的共价键,叫做非极性共价键。同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。非极性共价键存在于单质中,也存在于某些化合物中,完全由非极性键构成的分子一定是非极性分子(但有的非极性分子中含有极性键)。