与第一电离势相对应,基态气态原子获得一个电子成为气态一价负离子的能量称为该元素的第一电子亲和能,记为E1同样,也有第二、第三电子亲和能,记为E1(E2、E3)等。例如
Cl(g)+e- = Cl-(g) E1=-348.6kJ/mol
电子亲和能的大小反映了原子获得电子的难易。亲和能数值越大,则气态原子结合一个电子释放的能量越多,与电子的结合越稳定,表明该元素的原子越易获得电子,故非金属性越强。反之亦然。
电子亲和能难于直接测定,数据的完整性远不如电离能,且有较大误差。表4-4列出主族素的第一电子亲和能。
表4-4 主族元素的第一电子亲和能(kJ/mol)
| H -72.7 |
He +48.2 |
||||||
|
Li -59.6 |
Be +48.2 |
B -26.7 |
C -121.9 |
N +6.75 |
O -141.0 |
F -328.0 |
Ne +115.8 |
| Na -52.9 |
Mg +38.6 |
Al -42.5 |
Si -133.6 |
P -72.1 |
S -200.4 |
Cl -349.0 |
Ar +96.5 |
| K -48.4 |
Ca +28.9 |
Ga -28.9 |
Ge -115.8 |
As -78.2 |
Se -195.0 |
Br -324.7 |
Kr +96.5 |
| Rb -46.9 |
Sr +28.9 |
In -28.9 |
Sn -115.8 |
Sb -103.2 |
Te -190.2 |
I -295.1 |
Xe +77.2 |
电子亲和能的大小取决于原子的有效核电荷、原子半径和原子的电子构型。它们的周期性规律如图4-8所示。
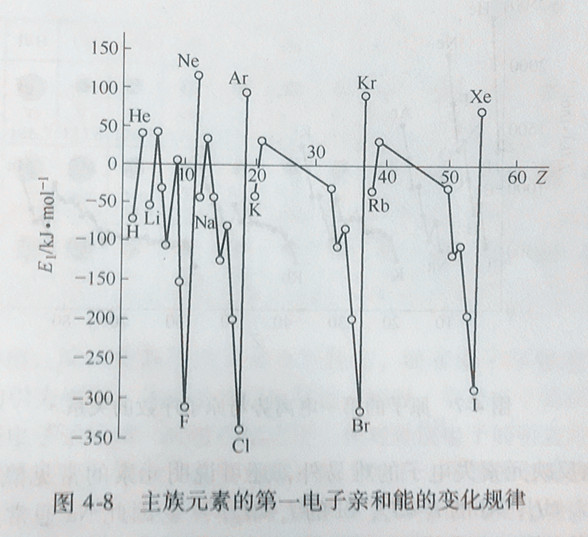
周期表中,同一周期从左到右,电子亲和能逐渐增大。因为原子有效核电荷增大,原子半径逐渐减小,随着最外层电子数目的增多,原子更易获得电子形成稳定结构,以卤族元素数值最大。同族元素从上到下电子亲和能逐渐减小。但第二周期N、O、F三元素反而比第三周期的P、S、Cl电子亲和能要小,这是因为N、O、F的原子半径很小,电子云密度很大,电子间斥力增大所致。有些元素素电离能较高,电子难以电离,并不意味着易于结合电子。例如稀有气体外层为8电子稳定构型,丢失电子和获得电子都不容易。