




原子的结构决定了元素的性质。原子的电子层结构随着原子序数的递增呈现周期性变化,导致元素的某些性质,如原子半径径、电离势、电子亲和能、电负性、金属性、氧化数等性质,也呈现周期性变化。先来介绍下原子半径与电离势的周期性变化。
原子半径
原子半径的大小主要取决于核外电子的层数和原子的有效核电荷。按照近代原子结构理论,核外电子呈几率分布,因而原子本身无明显的界面。但在单质和化合物中,原子常以化学键结合在一起,通常所说的原子半径是按照以下三种方法来确定的:
(1)共价半径:当两个相同原子以共价单键相连时,其核间距离的一半称为该原子的共价半径。例如把Cl-Cl分子的核间距的一半(99pm)定为Cl原子的共价半径(图4-6(a))。
(2)金属半径:金属单质的晶体中,两个相邻的金属原子核间距离的一半,称为该金属原子的金属半径。例如把金属铜中两个相邻Cu原子核间距的一半(128pm)定为Cu原子的半径(图4-6(b))。
(3)范德华半径:在分子晶体中,例如稀有气体晶体,相邻分子核间距的一半,称为该原子的范德华半径。例如Ne的范德华半径为160pm(图4-6(c))。
总之,金属原子取金属半径,非金属原子取共价半径,稀有气体原子取范德华半径。各元素原子的原子半径相对大小见表4-3。
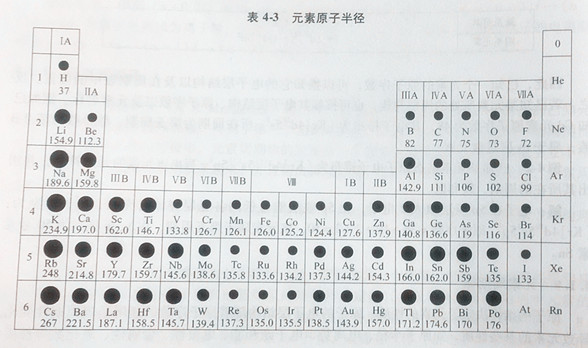
从表4-3可以看出,同一周期主族元素自左往右,随着原子序数递增,核核电荷数依次增加,核对外层电子的引力增强,使得电子向核靠近;同时,核外电子数增加,电子与电子之间的排斥力增加,使得电子远离核。两者相比之下,核对外层电子的引力增强起主导作用,所以原子半径变化的总趋势是逐渐减小。主族元素,从上往下,尽管核电荷数增多,但是电子层数的增多起主导作用,因此原子半径显著增加。副族元素有类似的变化规律,但不如主族元素明显。值得一提的是,镧系元素,从57La至71Lu,新增加的电子填人外数第三层(n-2)f轨道上,部分抵消核对外层ns电子的引力,使得原子半径收缩幅度很小,这种现象叫做系收缩。镧系收缩使得镧系元素的原子半径接近,电子构型相似,化学性质相近。系收缩导致其后的元素与相应上一周期的同族元素的原子半径非常接近,如Zr与Hf,Nb与Ta,Mo与W等,它们的化学性质也极相近,常共生于同一矿石中,并且分离困难。
电离势
电离势(I)是指基态气态原子或离子失去一个电子形成相应的气态离子所需的能量(单位为kJ/mol),例如
Mg(g)-e → Mg+(g);第一电离势I1=737.7kJ/mol
Mg+(g)-e → Mg2+(g);第二电离势I2=1450.7kJ/mol
电离势均为正值,且I1<I2<I3<…。元素原子的电离势反映了原子失去电子的难易程度:电离势越小,原子越容易失去电子;反之,电离势越大,原子越难失去电子。可以根据原子的电离势来衡量原子失去电子的难易程度。
元素原子的电离势可通过实验测出,图4-7给出了原子的第一电离势与原子序数的关系。由图可见,同一周期主族元素,自左往右,元素的I1总体上由小变大,到稀有气体达到最大值;副族元素自左往右,元素的I1变化不十分规律。同一主族元素,自上往下,元素的I1递减。副族元素自上往下原子半径只是略微增大,而且第五、六周期元素的原子半径又非常接近,核电荷数增多的因素起了作用,电离势变化没有较好的规律。同一周期中,元素的I1有些曲折变化,如从Li~Ne并非单调上升,Be、N、Ne都比相邻的两元素高,这是由于能量相同的轨道电子填充出现全充满、半充满或全空等状况。Li的I1最低,自Li到Be随着核电荷数的增加,电离势升高,这是由于Be的电子排布为2s2。B失去一个电子可得到2s22p2的电子构型,所以B的I1反而比Be低。N原子有较高的I1,因为它为半充满电子结构,O原子的I1低于N原子,因为它失去一个电子可以得到p3的电子构型,Ne为2s22p6的稳定结构,在这一周期中电离势最高。
电离势的大小除反映元素失电子的难易外,还可说明元素的常见氧化数。例如数据表明Na的I1﹤﹤I2,Mg的I2﹤﹤I3,Al的I3﹤﹤I4,Si的I4﹤﹤I5,…。因此Na通常为+1,Mg为+2,Al为+3。对于任何元素,第三电离势之后的各级电离势数值都较大,高于+3价的独立离子通常很少存在。