近代实验证明,强电解质溶液和弱电解质溶液的吸收光谱不同。强电解质溶液只有离子光谱,而弱电解质溶液浓度由浓到稀时,逐渐有分子光谱变为离子光谱。这就证明,强电解质在水溶液中是全部电离的,它们的电离度应该是100%。
但根据溶液导电性的实验和稀溶液依数性实验测得强电解质的电离度常常是小于100%。由实验测得的电离度,并不代表强电解质溶液中的实际电离度,它反映了溶液中离子间相互作用的强弱,因此称为表观电离度。某些强电解质溶液的表观电离度见表2-5。
表2-5 某些强电解质溶液的表观电离度(0.1mol/dm3,25℃)
| 电解质 | 电离式 | 表观电离度/% |
| KCl | KCl→K++Cl- | 0.85 |
| ZnSO4 | ZnSO4→Zn2++SO42- | 0.40 |
| HCl | HCl→H++Cl- | 0.92 |
| HNO3 | HNO3→H++NO3- | 0.92 |
| H2SO4 | H2SO4→2H++SO42- | 0.61 |
| NaOH | NaOH→Na++OH- |
0.91 |
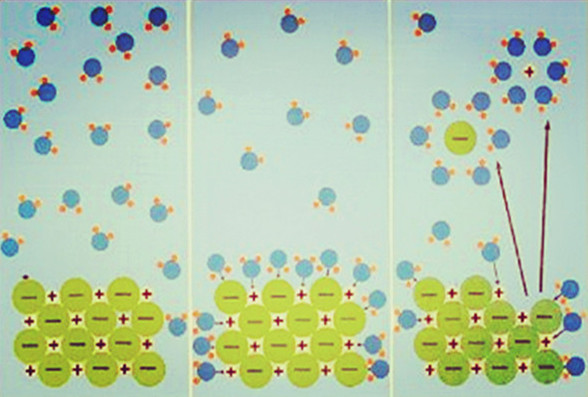
为了解释强电解质溶液电离度小于100%的现象,德德拜拜(P.Dobye)和休克尔(E.Huckel)提出了离子相互作用理论,又称为离子氛理论。认为强电解质在水中完全电离,但由于正负离子间的静电引力作用,正离子周围围绕着一些负离子,负离子周围围绕着一些正离子。这些围绕着的离子称为离子氛。由于离子的不断运动,离子氛随时拆开,又随时形成。溶液中的每一个离子均可作为中心离子,而与此同时它又是其他离子氛中的成员之一。由于离子氛的存在,离子受到牵制,不能完全独立运动。因而根据导电性实验测得强电解质的电离度小于100%。
强电解质溶液中正、负离子的相互吸引作用,不仅使表观电离度小于实际电离度,而且使发挥作用的离子的浓度也小于实际浓度。强电解质溶液中真正发挥作用的离子浓度称为有效浓度,也称为活度,用α表示。
活度α的数值等于实际离子浓度c乘以一个校正系数f
α= fc
式中,f为活度系数,用来反映电解质溶液中离子活动的自由程度的高低或相互牵制作用的大小。f的数值越小,离子自由活动的程度越低,离子的相互牵制作用越大。
f与离子浓度c和离子的电荷Z有关,通常用离子强度I来表达两个因素的综合作用。离子强度的定义为
I=1/2(c1Z12+c2Z22+…+cnZn2)=1/2(∑cizi2)
离子强度越高,活度系数越低,活度越小。当离子强度很小时,活度和浓度基本相等。
在准确计算中,都要使用活度。在一般化学计算中,准确度要求不高时,以浓度代替活度。