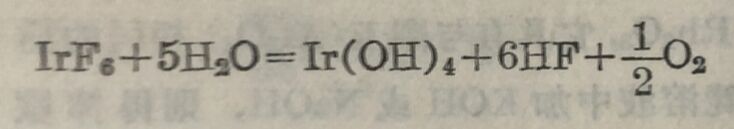正三价是銠与銥最特征的氧化态,但銥比較容易呈現更高的氧化态。銠在空气中加热或将硝酸銠加热,都可以获得灰黑色的三领化二銠Rh₂O₃,它具有与刚玉(Al₂O₂)相同的属于菱形晶系的秸构。硝酸銠溶液中加KOH或NaOH,期得榨檬黄色的沉淀Rh₂O₃·5H₂O,加热后即得不溶于酸的无永三氧化二銠Rh₂O₃。Rh₂O₃在减压下加热时亦可降为低价氧化物RhO和Rh₂O。但是这些低价氧化物都是不太稳定的。金屬銠在氯气流中加热至赤娥高温,即得不溶于水亦不溶于酸的紅色粉末状的无水三氯化銠RhCl₃。温度达440°C以上时,RhCl₃又复分解为銠和氯。銠的澳 化物和碘化物都与RhCl₃相似。銠与焦硫酸鉀反应,即得硫酸銠Rh₂(SO₄)₃。后者能生成M⁽ᴵ⁾Rh(SO₄)₂·12H₂O,称为銠矾,式中M⁽ᴵ⁾代表一价阳离子。
粉末状的金属銥在空气中加热,得二氧化銥IrO₂的黑色粉末。氯銥⁽ᴵᴵᴵ⁾酸鈉Na₃[IrCl₆]·12H₂O中的Ir是+3价,它的溶液与KOH反应,同时在溶液中通入氧气,即得二氧化銥的水合物IrO₂·2H₂O或Ir(OH)₄。在这个反应的过程中,最初形成紫色和 藍色的胶体溶液,继則析出IrO₂·2H₂O沉淀,沉淀的顏色是或青、或紫、或深藍、或黑,随着沉淀的情况而改变。用强氧化剂使三价銠氧化,虽亦可以得到二氧化銠的水合物,但它不十分稳定,产物中仍有Rh₂O₃混杂在内。氯銥⁽ᴵᴵᴵ⁾酸鈉Na₃IrCl₆溶液中加KOH溶液,容器中通入CO₂以避免氧化,即得三氧化二銥Ir₂O₃的水合物。如用KOH的稀溶液,則析出的沉淀呈綠色;如用KOH的濃溶液,則析出的沉淀呈黑色。粉末状的銥在氯气流中加热至 600-620°即得IrCl₃, 最初是称色粉末,逐漸轉变为黄色晶体。在 763-7739 范圍内,IrCl₃即失去氯而成IrCl₂,在773-798° 范團内叉轉变为IrCl(都在一个大气压的氯压下)。銥有一特点,耶粉末状的銥在萤石制的管子中通入纸,稍稍加热即得抓发性的黄色 六氟化銥IrF₆。IrF₆很活激,与水反应即分解而成Ir(OH)₄、HF及混有臭氧的氧气。
銠和銥的氧化态虽然都以+3价为特征,但是銥比較显著地具有呈現更高氧化态的傾向。
二、鈀和鉑的化合物
鈀与鉑在它們化合物中的氧化态,通常都是+2和+4,但鈀主要是正二价。鈀粉在氧气中加热即得不溶于任何酸(包括王水)的黑色粉末一氧化鈀PdO。从硝酸鈀溶液中水解(加碱)而析出的褐色沉淀,是一氧化鈀的水合物。若在氯鈀⁽ᴵᵛ⁾酸盐PaCl₆⁻⁻溶液中加KOH或NaOH,則可得从深紅色逐渐变为黑色的PdO₂的水合物。PdO₂加热到200°即完全分解为PdO,甚至在室溫下亦逐淅进行分解。二价鈀化合物的溶液中通入H₂S,即得深褐色的 PdS沉淀。二氯化鈀PdCl₂与硫黄混和加热至450-500, 可得+4价的硫化物PdS₂,但在600°以上PdS₂即分解为S和PdS。PdO的水合物溶于盐酸即得深褐色的PdCl₄·2H₂O;溶于硫酸即得紅棕色的PdSO₄·2H₂O;溶于硝酸即得棕黄色的Pd(NO₃)₂。二氯化鈀的溶液遇一氧化碳、乙烯、甲烷以及其他还原性气体,即行褪色,同时析出金屬鈀。因此,用浸过极稀的PdCl₂溶液的滤紙,可以檢驗微量的一氧化碳,而且非常灵敏。
鉑的氧化物中以二氧化鉑PtO₂(氧化态+4)最为稳定。四氯化鉑溶液中加碱后煮沸即有紅棕色的PtO₂水合物析出。二氧化鉑的水合物經加热,并維持在200°的温度,羥过較长的时間后即开始分解为鉑和氧。鉑的氧化物中最不稳定的是三氧化鉑PtO₃。将PtO₂溶于KOH溶液中在0°以下电解,在阳极上即淀积一层 金黄色的3PtO₃·K₂O,用稀醋酸加以处理,即得PtO₃。PtO₃在室温下即慢慢地分解,如稍加热则分解較快,轉化为PIO₂。氧化态为+2的一氧化鉑PtO,并不存在。四氯鉑⁽ᴵᴵ⁾酸鉀K₂PtCl₄,的溶液和KOH反应所得的黑色沉淀是Pt(OH)₂。二氧化鉑的水合物溶于浪硫酸后,用草酸使它还原,即得二硫酸基合鉑酸H[Pt(SO₄)₂]。二硫酸基合鉑酸和NaOH反应,得氧化态为+3的Pt₂O₃水合物,在氧气中加热,立即氧化面成PtO₂,因此Pt₂O₃亦是不稳定的。氧化态为+2的PtS和氧化态为+4的PtS₂都可以制得。PtS可用鉑的精細粉末和硫黃华混合加热来直接合成;在四氯鉑⁽ᴵᴵ⁾酸或它的盐的溶液中通入H₂S也析出PtS的灰黑色沉淀。
PtCl₄⁻⁻+H₂S=PtS↓+2H⁺+4Cl⁻
在六氯鉑⁽ᴵᵛ⁾酸盐溶液中通入H₂S即得黑色的PtS沉淀。
PtCl₆⁻⁻+2H₂S=PtS₂↓+4H⁺+6Cl⁻
鉑有四种价数不同的氯化物,但一氯化鉑PtCl仅能在581-583°这一很狹窄的溫度范圍內存在。将H₂PtCl₆在氯气流中加热达300°左右即得紅棕色的四氯化鉑PtCl₄。PtCI₄只能在370° 以下存在,加热时即行分解,在370-435°范圍内分解为暗缘色的三氯化鉑PtCl₃,在435-581° 范圍内分解为二氯化鉑PtCl₂。
PtCl₂溶于盐酸即得四氣鉑⁽ᴵᴵ⁾酸H₂PtCl₄, 并含有一小部分的Pt和H₂PtCl₆。
PtCl₂+2HCl=H₂PtCl₄
2PtOl₂+2HCl=H₂PtCl₆+Pt
四氯鉑⁽ᴵᴵ⁾酸只存在于溶液中,它的鉀盐K₂PtCl₄是易溶于水的暗紅色晶体(晶体结构,見图16 -2)。PtCI₄溶于盐酸即得六氯鉑⁽ᴵᴵ⁾酸H₂PtCl₆,同时放出大量的热。六氯鉑⁽ᴵᵛ⁾酸亦称氯鉑酸,它的銨盐、鉀盐、銣盐、銫盐等都是难溶的黄色盐,因此有时可用H₂PtCl₆来檢驗NH₄⁺、K⁺、 Rb⁺、 Cs⁺等离子。在六氯鉑⁽ᴵᵛ⁾酸的溶液中通入二氧化硫,它即被还原为四氯鉑⁽ᴵᴵ⁾酸。
鉑系金屬和铁系金屬一样,都是最显著的絡合物形成体,主要因为这些元素都具有不稳定的d层电子。以鉑系金屬的絡合物作为研究的对象,已有很久的历史。絡合物的研究更能显示鉑系金屬的特征。