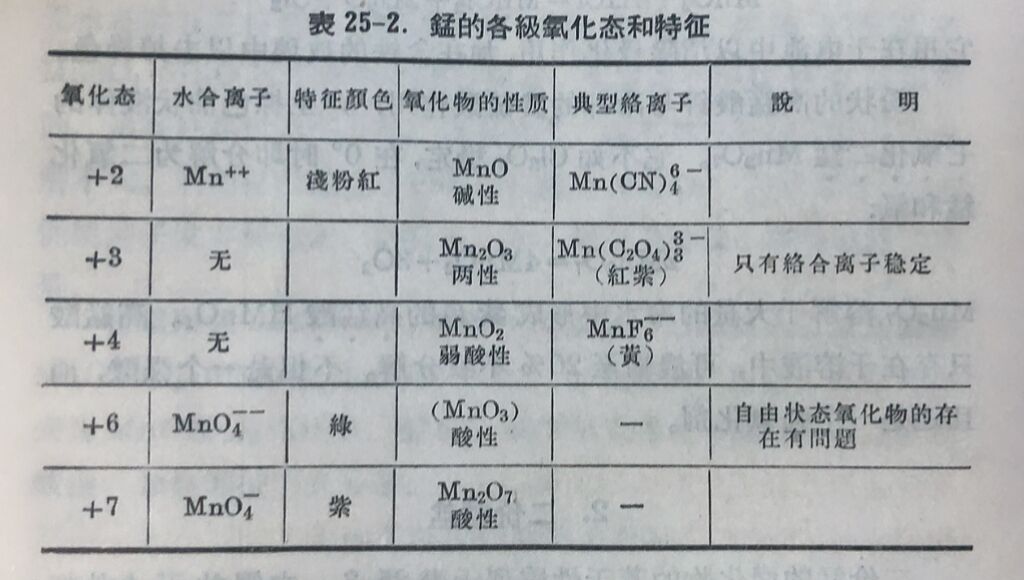
1.氧化物和氫氧化物
把二氧化錳放在氫气流中加热到1200°,得一氧化錳MnO。它是暗綠色粉末,不溶于水,溶于酸中形成二价錳盐。
在二价錳盐溶液中加入强碱,可析出白色胶状氫氧化錳⁽ᴵᴵ⁾Mn(OH)₂,显碱性。它在碱性介质中很不稳定,与空气接触即形成棕色的Mn₂O₃·xH₂O或MnO₂·yH₂O。
把二氧化錳在氨气流中加热,可得棕黑色的三氧化二錳Mn₂O₃。
6MnO₂+2NH₃=3Mn₂O₃+N₂+3H₂O
在自然界中它常以水合物的形式存在,如Mn₂O₃·H₂O或MnO(OH),称为水錳矿,与FeO(OH)和AlO(OH)同晶。相应的氫氧化物几不溶于水,且具有两性。
二氧化錳存在于自然界,是一种重要氧化物,显弱酸性。常被用做催化剂,如增加氯酸鉀或过氧化氫的分解速度和油漆在空气中的氧化速度。它也是一个强氧化剂,与濃盐酸作用放出氯气。
MnO₂+4HCl=MnCl₂+2H₂O+Cl₂
它用在干电池中以消除极化作用,加在含铁的玻璃中以去掉称色。
粉状的高錳酸鉀与冷却的濃硫酸作用,产生棕色油状液体的七氧化二錳Mn₂O₇。它不如Cl₂O₇稳定,在0°时即分解为二氧化錳和氧:
2Mn₂O₇=4MnO₂+3O₂
Mn₂O₇溶解于大量的冷水中形成紫色的高錳酸HMnO₄。高錳酸只存在于溶液中,可濃缩至20%不致分解。不但是一个强酸,而且还是一个强氧化剂。
2.二价錳盐
二价錳的卤化物的若干性质列于表25-3.它們的无水盐都是淡紅色。除二氟化錳外錳的卤化物都易溶于水。将碳酸錳⁽ᴵᴵ⁾溶于盐酸中并在58°以下蒸发即得四水合二氯化錳MnCl·4H₂O。 MnO₂—Mn⁺⁺电偶的电位E⁰=1.229伏。由此可見,Mn⁺⁺在碱性介质中很容易氧化为MnO₂。
表25-3 卤化锰MnX₂的性质
| 性质 |
MnF₂
|
MnCl₂
|
MnBr₂ |
MnI₂
|
|
颜色
熔点,°C
溶解度
水合物,水分子数
生成热,千卡/克分子
|
淡红
856
微溶
4
206.0
|
淡红
650
易溶
2、4、6
112.69
|
淡红
分解
易溶
2、4、6
90.80
|
淡红
分解
易溶
1、2、4、6、9
76.46
|
MnCl₂+Na₂O₂=MnO₂+2NaCl
MnCl₂+2KMnO₄+2H₂O=5MnO₂+2KCl+4HCl
二氧化錳与濃硫酸作用則得硫酸錳⁽ᴵᴵ⁾MnSO₄。
2MnO₂+2H₂SO₄=2MnSO₄+2H₂O+O₂
无水硫酸盐是白色。自溶液中可析出政瑰红色的水合晶体MnSO₄·5H₂O与CuSO₄·5H₂O同晶。它是在二价錳盐中最稳定的,虽在紅热时也不分解,故与铁⁽ᴵᴵ⁾鎳⁽ᴵᴵ⁾等硫酸盐因强热而分解不同。利用硫酸錳这个特性可以純化MnSO₄。在农业上它有促使种子发芽的作用。晒盐时,加入微量硫酸錳,可提高盐的质量。
一将碳酸錳MnCO₃溶于硝酸中,在室温下蒸发,六水合硝酸錳 Mn(NO₃)₂·6H₂O就自溶液中析出。加热到 25°以上,部分脫水变为Mn(NO₃)₂·3H₂O。在18°,每100克水中可溶134克无水硝酸錳。加热即按下式分解:
Mn(NO₃)₂=MnO₂+2NO₂
因此它可用于制备化学純的二氧化錳。
在难溶的二价錳盐中,比較重要的有碳酸錳⁽ᴵᴵ⁾MnCO₃,磷酸銨錳Mn(NH₄)PO₄和硫化錳MnS。
在含有NH₄CI和Mn⁺⁺的溶液中,加入氨水和磷酸盐,可析出Mn(NH₄)PO₄:
Mn⁺⁺+NH₄⁺+PO₄³⁺+6H₂O=MnNH₄PO₄·6H₂O↓
经灼燒变为焦磷酸錳Mn₂P₂O₇,在分析化学中可用来测定錳。
加硫化銨試剂于二价錳盐溶液中,即得深肉色的硫化錳MnS·xH₂O沉淀。无水的MnS是綠色。溶度积为14x10⁻¹⁵,象醋酸这样的弱酸也可以使它溶解,因此它不能在酸性介质中沉淀。
3.錳酸盐
二氧化錳与碱混合,在空气中加热共熔,可制得綠色的錳酸盐,也可以用KClO₃之类的氧化剂来代替空气中的氧:
2MnO₂+4KOH+O₂=2K₂MnO₄+2H₂O
3MnO₂+6KOH+KClO₃=3K₂MnO₄+KCl+3H₂O
錳酸鉀无水合物而錳酸鈉則有水合物。錳酸根离子MnO₄⁻⁻呈深綠色,在水溶液中发生下列的水解歧化作用:
3MnO₄⁻⁻+2H₂O=MnO₂+2MnO₄⁻+4OH⁻
如在溶液中加入NaOH使变成强碱性,則上列平衡反应向左移动,紫色的高錳酸根离子MnO₄⁻消失,溶液呈深綠色。相反地如使溶液变为酸性,錳酸盐即歧化为MnO₄⁻和MnO₂。由此可見,只有在强碱性介质中,锰酸盐才是稳定的。