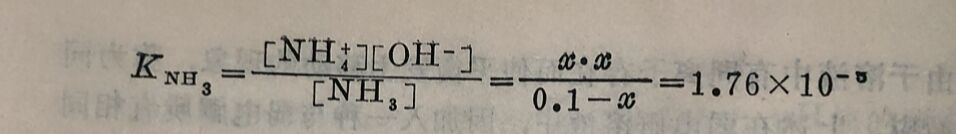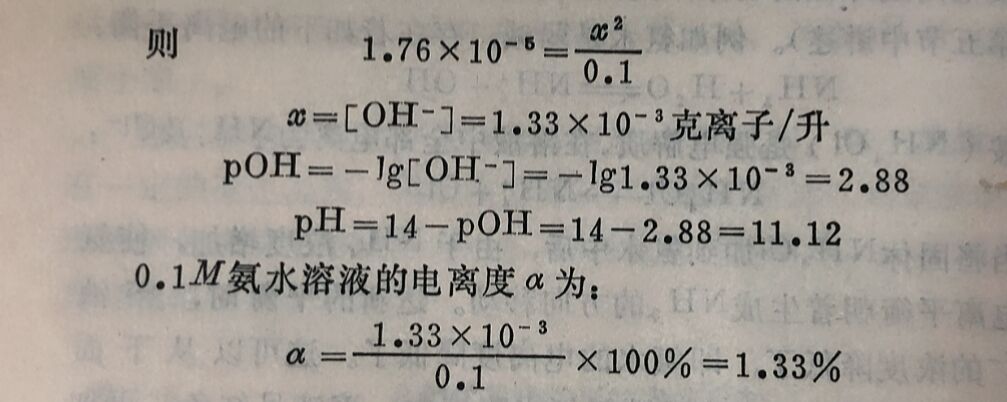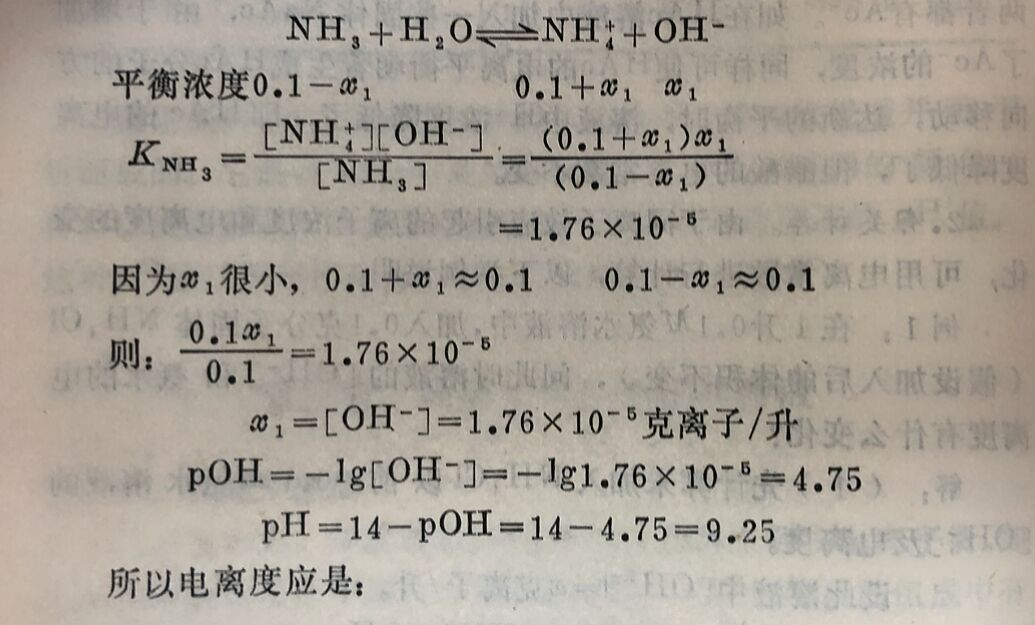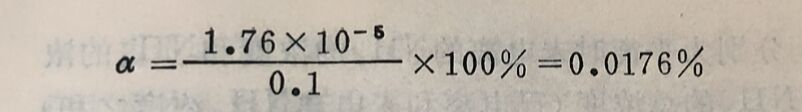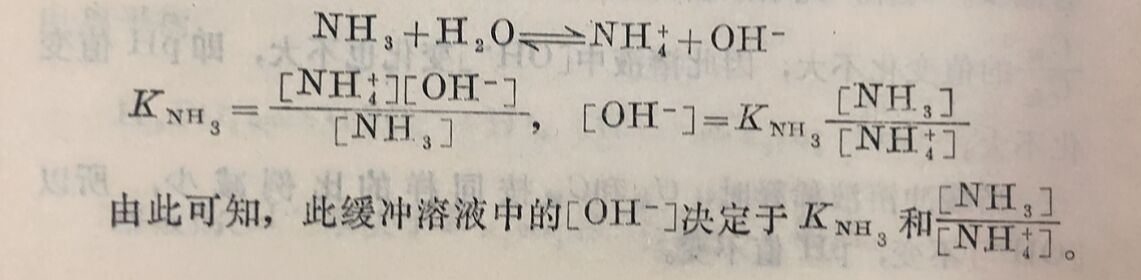同离子效应和缓冲溶液
铜臭 / 2022-07-21
一、同离子效应
1.产生原因。如前所述,弱电解质在溶液中存在电离平衡。如在弱电解质的溶液中加入--种强电解质,此强电解质的组成中有一种和弱电解质相同的离子(即同离子),则弱电解质的电离平衡就会发生移动,电离度也会发生变化。
由于溶液中有同离子存在而使平衡发生移动的现象,称为同离子效应。上述在弱电解溶液中,因加入一种与弱电解质有相同离子的强电解质后,使弱电解质的电离平衡发生移动,从而使弱电解质电离度降低的现象,是同离子效应中的一一种。例如氨水是弱碱,存在着如下的电离平衡:
NH₃+H₂O⇔NH₄⁺+OH⁻
氯化铵( NH₄Cl)是强电解质,在溶液中全部电离为NH₄⁺及Cl⁻:
NH₄CI→NH₄⁺+CI⁻
当将固体NH₄CI加到氨水中后,由于NH₄⁺浓度增加,使氨水的电离平衡朝着生成NH:的方向移动。达新的平衡时,溶液中OH⁻的浓度降低了,即氨水的电离度降低子。这可以从下面的实验得到证明,加几滴酚酞于氨水溶液中,溶液呈红色,再加入一定量的固体NH₄CI后,溶液即转变为无色。这就是说,溶液中OH减少了,虽氨水的电离常数没有变,但氨水的电离度却降低了。
又如醋酸( HAc,弱酸)和其盐醋酸钠( NaAc,强电解质),两者都有Ac⁻。如在HAc溶液中加入一些固体NaAc,由于增加了Ac⁻的浓度,同样可使HAc的电离平衡朝着生成HAc分子的方向移动,达新的平衡时,溶液中H浓度降低了,即HAc的电离度降低了,但醋酸的电离常数不变。
2.有关计算。由于同离子效应引起的离子浓度和电离度的变化,可用电离常数进行计算,以下举例说明:
例1 :在1升0.1M氨水溶液中,加入0.1克分子固体NH₄CI(假设加入后的体积不变),问此时溶液的[OH⁻]和氨水的电离度有什么变化?
因为0.1-x中的x与0.1比较,其值很小。所以0.1-x≈0.1
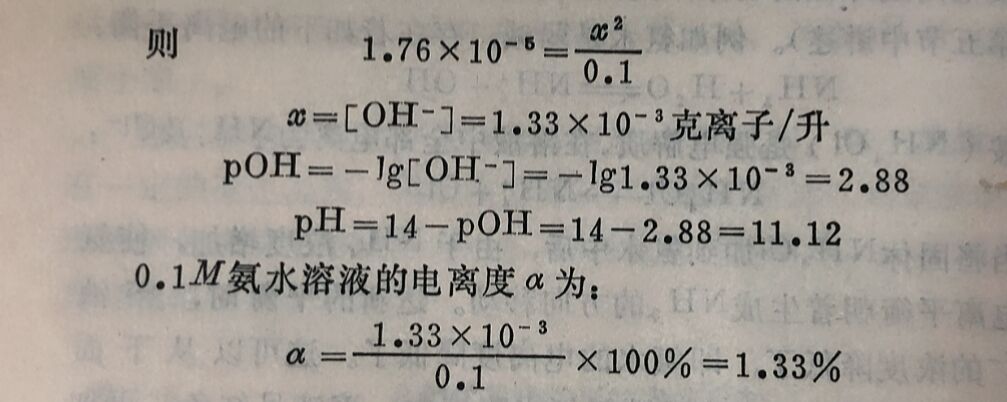
(2)再计算加入0.1M固体NH₄CI后,混合溶液的[OH⁻]及氨水的电离度。
因为NH₄CI在溶液中完全电离,所以它电离出的NH₄⁺浓度为0.1M。设x₁为达平衡时已电离NH₃的克分子浓度,[NH₄⁺]应是氯化铵和氨水电离生成的NH₄⁺克离子浓度之和,则:
答:在氨水中加入NH₄CI,使氨溶液中的[OH⁻]由1.33×10⁻³克离子/升降低到1.76×10⁻⁵克离子/升;氨溶液的电离度由1.33%降低到0.0176%,即都降低到原来的1/75。
在化学分析和化工生产中经常应用同离子效应。例如同离子效应可以稳定溶液中H的浓度,达到控制溶液的pH值的作用以及控制盐类的水解和促使某种离子从溶液中沉淀出来等等。
二、缓冲溶液
在氨水溶液中加入一定量的固体氯化铵后,由于同离子效应,不仅能使氨水的电离度降低,而更重要的是能使溶液中的H⁺浓度在一定限度内不受加入酸碱和溶液稀释的影响,保持相对的稳定。这种在定程度上能抵御外来酸、碱或稀释的影响,使溶液的pH值不发生显著改变的作用,称为缓冲作用;具有缓冲作用的溶液称为缓冲溶液。如NH₃-NH₄Cl混合液,HAc-NaAc混合液都有缓冲作用,因此都是缓冲溶液。
1.缓冲原理和pH计算:
(1)缓冲原理。为什么缓冲溶液具有缓冲能力呢?要理解这个问题,需要首先了解决定缓冲溶液中H⁺浓度或OH⁻浓度的因素,然后才能知道缓冲溶液为什么具有缓冲作用。下面将各类缓冲溶液的缓冲原理分别加以讨论:
1)弱碱及其盐。这类缓冲溶液的缓冲作用,以NH₃-NH₄Cl混合液为例加以说明。混合液中的NH₄CI全部电离:
NH₄Cl=NH₄⁺+Cl⁻
弱碱氨存在电离平衡:
[NH₃]和[NH₄⁺]分别为平衡时未电离的NH₃的浓度和NH₄⁺的浓度。[NH₃]应为NH₃的总浓度(已电离和未电离NH₃浓度之和)减去已电离的NH₃浓度。[NH₄⁺]应为NH₄Cl和NH₃电离得的NH₄⁺浓度之和。由于同离子效应,使NH₃的电离度大为降低,即已电离的NH₃浓度和由NH₃电离得来的NH₄⁺浓度都大为降低,都可忽略不计,因此可将NH₃的总浓度CNH₃,作为[NH₃],盐的浓度CNH₄Ol,作为[NH₄⁺],代入氨的电离常数式中,即得:
由此可知,各种弱碱及其盐的混合液中的[OH⁻]决定于 弱碱的电离常数( K碱)和碱与盐浓度的比值(C碱/C盐)。




![2,2-双[4-(4-氨基苯氧基苯)]六氟丙烷](images/202103/thumb_img/3458_thumb_G_1615773264954.jpg)