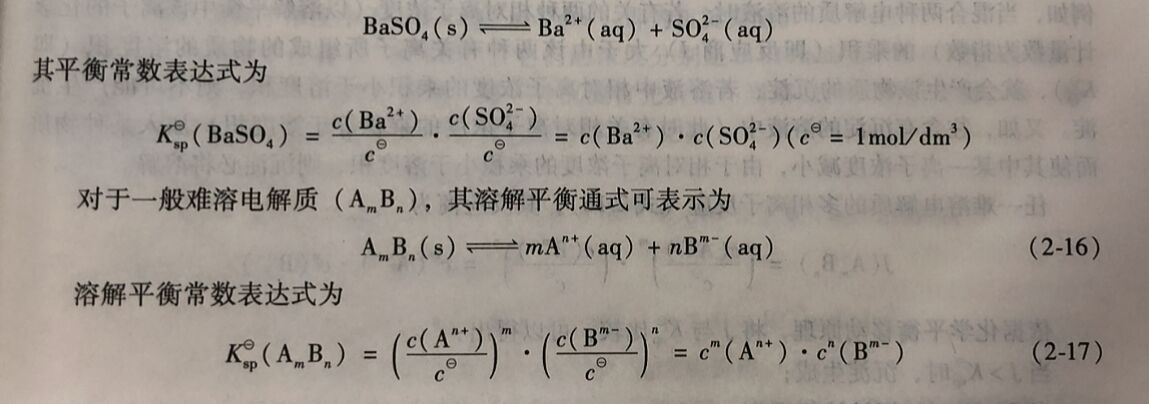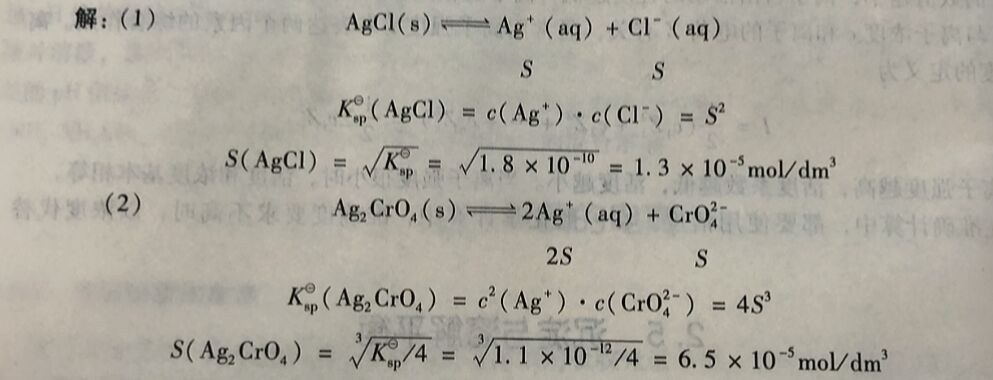式(2-17)表明,在难溶电解质的饱和溶液中,当温度定时, 各组分离子浓度幂的乘积为一常数,称作溶度积常数,简称溶度积。
Ksp与其他平衡常数一样,是温度的函数。其数值既可由实验测得,也可以用热力学数据来计算。
2.5.1.2 溶度积和溶解度的相互换算
溶度积和溶解度的数值都可以用来表示难溶电解质的溶解能力。它们之间可以相互换算,既可以从溶解度求溶度积,也可以从溶度积求溶解度。在换算时要注意所用的浓度单位必须使用mol/dm³。
例2-13在25°C时氯化银的溶度积为 1.8x10⁻¹⁰,铬酸银的溶度积为1.1x10⁻¹²,试求氣化银和铬酸银的溶解度。
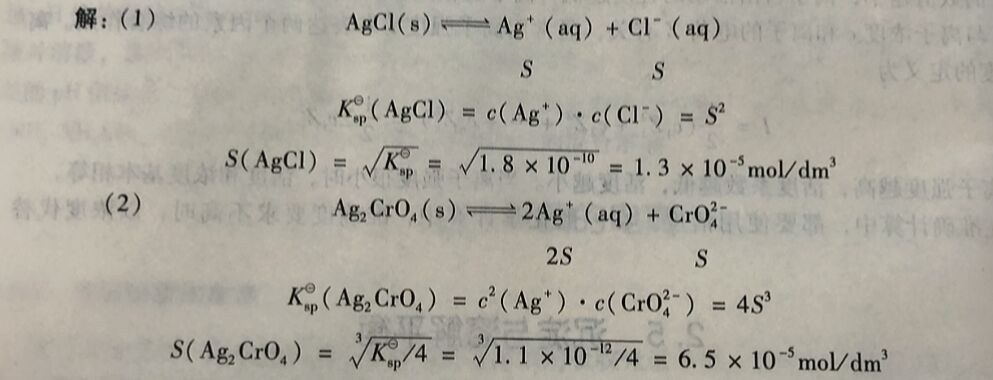
注意, 上述溶度积与溶解度的换算是一种近似的计算, 忽略了难溶电解质的离子与水的作 用等情况。该计算结果表明,AgCl 的溶度积Ksp虽比Ag₂CrO₄的Ksp大,但AgCl的溶解度 (1.34x10⁻⁵mol/dm³) 反而比Ag₂CrO₄的溶解度(6.5x10⁻⁵mol/dm³) 要小。这是因为 AgCl 是AB型难溶电解质,Ag₂CrO₄ 是A₂B型难溶电解质。对于同一类型的难溶电解质,可以通过 溶度积的大小来比较它们的溶解度的大小。例如,均属AB型的难溶电解质AgCl、BaSO,₄和CaCO,₃,在相同温度下,溶度积越大,溶解度也越大;反之亦然。但对于不同类型的难溶电解质,则不能用溶度积直接比较溶解度的大小。
2.5.2溶度积规则及其应用
对一给定难溶电解质来说,在一定条件下沉淀能否生成或溶解可从溶度积的概念来判断。例如,当混合两种电解质的溶液时,若有关的两种相对离子浓度(以溶解平衡中该离子的化学计量数为指数)的乘积(即反应商J)大于由该两种有关离子所组成的物质的溶度积(即Ksp),就会产生该物质的沉淀;若溶液中相对离子浓度的乘积小于溶度积,则不可能产生沉 淀。又如,往含有沉淀的溶液中( 此时有关相对离子浓度的乘积等于溶度积)加人某种物质 而使其中某一离子浓度减小, 由于相对离子浓度的乘积小于溶度积,则沉淀必将溶解。
任一难溶电解质的多相离子反应(式2-16),其反应商为
依据化学平衡移动原理,将J与Ksp比较,可以得出:
当J>Ksp时,沉淀生成;
当J=Ksp时,沉淀溶解平衡;
当J<Ksp时,无沉淀生成或沉淀常解。
以上规律即为溶度积规则。应用溶度积规则可以判断沉淀的生成和容解。
2.5.21判断沉淀能否生成
2.5.2.2分步沉淀
溶液中往往同时含有几种离子,当加人某种沉淀剂时,可能与溶液中几种离子都能反应而产生沉淀。例如,在含有等浓度的CI⁻和I⁻混合溶液中,逐滴加入AgNO₃溶液,先是产生黄色的AgCl沉淀,后来才出现白色的AgCl沉淀,这种先后沉定的现象称为分步沉淀。
为什么沉淀次序会有先后呢?可以根据溶度积规则来说明,溶液中离子浓度乘积先达到溶度积的先沉定,后达到的后沉定。在实际工作中,常利用分步沉淀控制条件,以达到分离离子 的目的。一般认为离子浓度小于 1.0x10⁻⁵moI/dm³,即为沉淀完全。
2.5.2.3同离子效应
在难溶电解质的饱和溶液中加人含有相同离子的强电解质时,难溶电解质的多相离子平衡将发生移动。例如,在BaSO₄饱和溶液中,加入含有相同离子的Na₂SO₄由于SO₄²⁻离子浓度增大,J>Ksp,平衡向生成BaSO₄沉淀的方向移动,直到溶液中离子浓度乘积等于溶度积为止。当达到新平衡时,溶液中的Ba²⁺浓度减小了,也就是降低了BaSO₄的溶解度。这种因加人含有相同离子的强电解质,而使难溶电解质溶解度降低的现象也称作同离子效应。