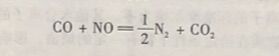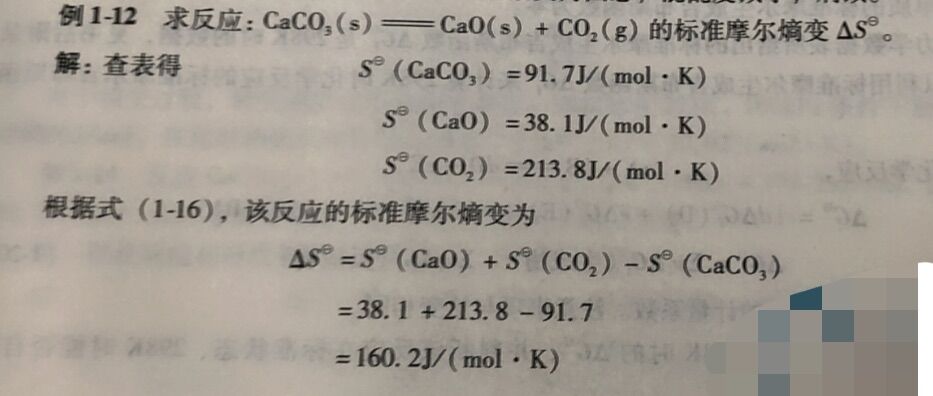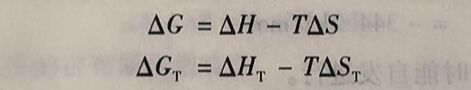因此,用反应的热效应或者常变作为反应自发性的普遍性判据是有局限性的,是不妥当 的。这说明除了馆变这一重要因素外, 还有其他因素影响化学反应自发进行的方向。
1.4.2.2墒和熵变
前面提到自然界有一类自发过程的普遍情况,即系统倾向于取得最低的势能。实际上,还 有另一类自发过程的普遍情况。例如,往杯水中滴人几滴蓝墨水, 蓝墨水就会自发地逐渐扩散列整杯水中,这个过程不能自发地逆向进行。在一.密闭容器中, 中闻用隔板隔开,一半装氨气,一半装氢气,两边气体的压力和温度相同:去掉隔板后,两种气体自动扩散,形成均匀的混合气体,这种混合均匀的气体放置多久也恢复不了原状。氨气和氢气相互混合的过程是自发进行的。混合后气体分子处于种更加混乱无序的状态。
上面两个例子说明系统能自发地向混乱度增大的方向进行。也就是说系统倾向于取得最大 的混乱度。热力学上用一个新函数一嫡来表示系统的混乱度, 或者说系统的情是系统内物质微观粒子的混乱度或无序度的量度,用符号S表示。系统的混乱度越大,熵值就越大。墒与焓.一样,也是状态函数。熵值的增加表示系统混乱度增加。
在绝对零度时,理想品体内的分子各种运动都将停止,物质微观粒子处于完全整齐有序的状态。根据这种观点,总结出热力学第三定律,即在绝对零度时,任何纯净的完美晶体的嫡值为零。在某温度T时,1mol纯物质的嫡值叫做该物质的摩尔墒。在标准状态下,1mol纯物质的摩尔熵叫做该物质的标准摩尔熵。以符号S表示,单位为J/(mol.K)。注意稳定单质的标准摩尔嫡不是零。对于水合离子,规定298K,标准状态下水合氢离子的标准摩尔熵为零。其他水合离子的标准摩尔熵由此得到。
熵是状态函数,每种物质在给定条件下都有一定的墙值。 影响标准摩尔熵的因素有物质的聚集状态、温度、分子的大小、硬度等。其规律如下:
(1)对于同一物质的不同聚集状态来说,气态的情值最大,液态的熵值其次,固态的嫡 值最小。即S(g) > S(I) > S(s)。
(2)对于同一物质的相同聚集状态来说,温度越高,热运动增加,系统混乱度越大,其熵值越大。即S(高温) > S(低温)。
(3) 对于相同聚集状态的不同物质来说,嫡值的大小与分子的组成和结构有关。一般来说, 分子越大,结构越复杂,混乱度就越大,嫡值也越大。所以复杂分子组成的物质的熵值比 简单分子组成的物质的嫡值大,即S(复杂分子) > S(简单分子)。对于固体单质,硬度越大,熵值越小。
(4)混合物或溶液的嫡值比相应的纯物质的嫡值大,即S(混合物) > S(纯净物)。
有了各种物质的标准摩尔熵S的数值后,就可以求得化学反应的标准摩尔熵的变化,即标准摩尔嫡变,用符号Δs表示。计算反应的标准摩尔嫡变和计算反应的标准摩尔焓变相似。

虽然物质的墙值随温度的开高面增大,但只要温度的升高没有引起物质聚集状态的改变,则生成物的标准嫡的总和随温度升高而引起的增大与反应物的标准境的总和的增大通常相差不大,大致可以相互抵清。所以化学反应的情变随温度变化不大,作近似计算时,可以不考虑温度对反应熵变的影响。
例1-11判断下列反应系统是熵增还是嫡减。
(1)少量蔗糖溶于水中;
(2)碘的升华;
(3)石灰石受热分解;
(4) 硫酸铜溶液结晶。
解: (1)蔗糖溶于水中,由固态物质变为溶液,混乱度增大,熵增。
(2)碘的升华,由固态物质变为气态物质,混乱度增大,熵增。
(3)石灰石受热分解,CaCO₃(s)一CaO(s) + CO₂(g),伴随有气体的生成,混乱度增大,熵增。
(4)硫酸溶液结晶出硫酸铜固体,由溶液变为固态,混乱度减小,熵减。
例1-12求反应: CaCO₃(s)一= CaO(s) + CO₂(g)的标准摩尔熵变ΔS
1.4.3化学反应 自发过程的判断和吉布斯函数变
1.4.3.1 吉布斯函数变与自发过程
前面提到,化学反应的自发性不仅与反应的焓变ΔH有关,还与反应的熵变ΔS有关。判断化学反应的自发性必须将这两点结合起来。1876 年,美国科学家吉布斯提出一个把焓变和熵变统一在一起的吉布斯函数,并且用吉布斯函数作为恒温恒压下判断化学反应方向的标准。吉布斯函数用符号G表示。
吉布斯函数的定义式为
G≡H-TS
式中,吉布斯函数G是状态函数H、T和S的组合,所以吉布斯函数G也是状态函数。吉布斯函数的变化即吉布斯函数变,用ΔG表示。对于恒温过程
该公式表明,恒温恒压下进行的化学反应,其吉布斯函数变由化学反应的焓变和熵变以及温度所决定。
吉布斯函数变AG可以作为在恒温恒压条件下,任意过程或反应自发性的判据。即
ΔG<0,反应自发进行。
ΔG>0,反应非自发进行,逆向自发进行。
ΔG=0,系统处于平衡状态。
ΔG的符号与ΔH、ΔS符号的关系见表1-1。
表1-1 ΔG的符号与ΔH、ΔS符号的关系
| ΔH |
ΔS |
ΔG |
ΔH |
ΔS |
ΔG |
| - |
+ |
(-)任何温度下为自发反应 |
+ |
+ |
高温时为自发反应 |
| + |
- |
(+)任何温度下为非自发反应 |
- |
- |
低温时为自发反应 |