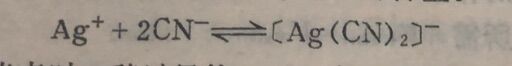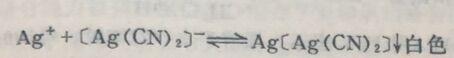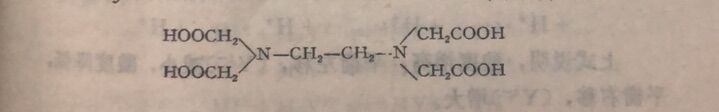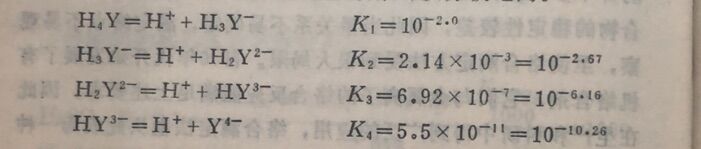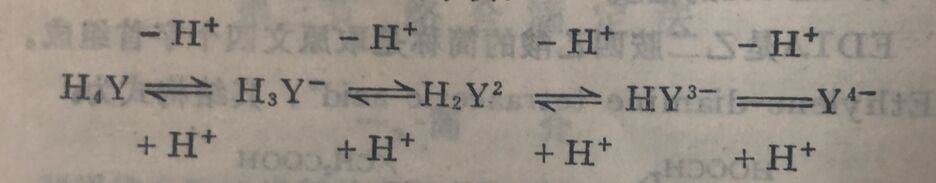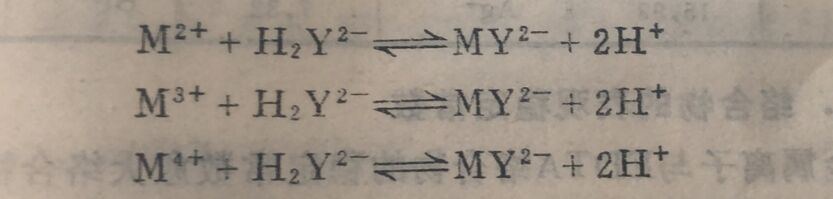从EDTA的四个电离常数可以看出,它的第一级和第二级电离常数是比较大的,因此它有二元中强酸的性质。
由于EDTA在溶液中分四步电离,所以在任何酸度下 EDTA总是以H₄Y, H₃Y⁻, H₂Y²⁻, HY³⁻, Y⁴⁻五种形式同时存在于溶液中,且有下列平衡:
上式说明,酸度增高,平衡左移,(Y⁴⁻)减小,酸度降低,平衡右移,[Y⁴⁻]增大。
2. EDTA与金属离子络合的特点
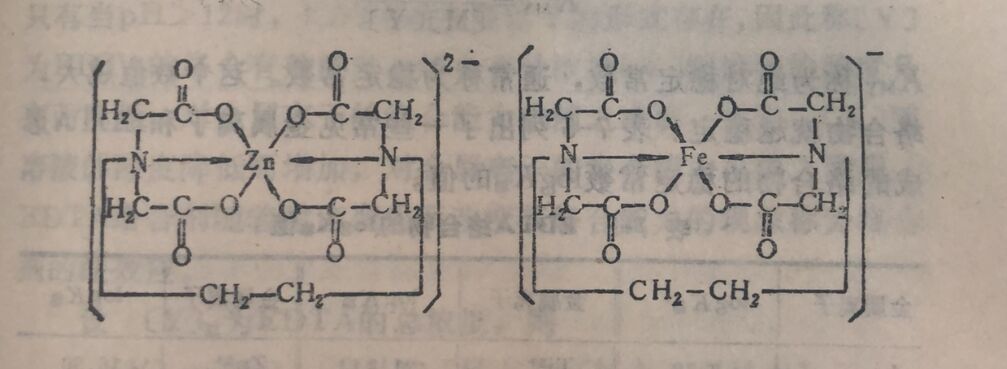
①EDTA所以适用于作络合滴定剂是由它本身所具有的特殊结构决定的。从它的结构式可以看出,它同时具有氨氨和羧氧二种络合能力很强的配位基,综合了氨和氧的络合能力,因此EDTA几乎能与周期表中大部分金属离子络合,形成具有五节环结构的稳定的络合物。
②在一个EDTA分子中,由二个氨氨和四个羧氧提供了六个配位原子,它完全能满足一个金属离子所需要的配位数。其结构式如下:
从上述绪构式可看出EDTA与金属离子络合后形成稳定性较强的五节环内络合物。具有这种环形结构的络合物称蛰合物。
③EDTA与金属离子络合的特点是不论金属离子是几价的,它们都是以1:1的关系络合,同时释放出两个H⁺,反应式如下:
因此EDTA标准溶液的浓度常以摩尔浓度来表示,并且用毫克摩尔数相等的原则进行计算。