







各种物质对电流都有不同的阻力。根据欧姆定律,当温度一定时,电阻与导体的长度L成正比,而与横截面积积A成反比,即
R=P L/A
式中p为电阻率,即长1厘米,截截面1平方厘米的导体所具有的电阻(欧姆)。不同的物质,P的数值不同。P与物质的性质有关。
1/R=A/PL=K A/L
式中,K是电阻率的倒数,称为电导率。
在两电极间平行相距1厘米时所含有该离子浓度为一个当量的电导称为当量电导。

以A代表当量电导,因为L=1厘米
A=KA
∴ 由于两电极相距1厘米,故溶液的横截面积的数值和溶液的体积的数值相等,即
A=KV
若溶液的当量浓度为C,则每含一克当量电解质的溶液的毫升数为1000/C,代入上式得,
A=KV=K 1000/C
K=AC/1000
在电导池中,距离为L厘米,面积为A厘米2的两个电极间所包括的电解质(浓度C)的电导为::
1/R=KA/L=AC/1000·A/L
电导池的L和A是固定的,L/A的比值称为电导池常数,以Q代表之,则(6)式可表示为:
1/R=AC/1000·1/C
电解质的当量电导(A)是它的离离子的当量电导(入+、入-)的总和。
一个电解质溶液的总电导是它所有离子电导的总和:
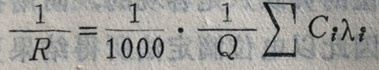
式中C;代表某一离子的当量浓度,入;代表该离子的当量电导。由上式可知,一个溶液电导的大小,决定于溶液中所有离子的多少。
在电导滴定中,将一电解质溶液滴加于被测电解质溶液中,由于它们间发生化学变化,所产生新离子的电导与原离子电导不同,从而使得整个溶液的电导随试剂的加入而变化。以溶液的电导为纵轴,加入试剂量为横轴作滴定曲线,可求其滴定终点。由于电解质的离解度不同,所得滴定曲线也就不一样。
假如加电解质CD于AB中,溶液总体积保持不变,并且AB中的B与CD中的D产生难溶解或难电离的物质BD,则其反应为;
B+(被测定的离子)+A-+[C++D-(试剂)]→BD(难溶解或难电离解质)+A-+C+
由于溶液的电导与溶液中每个离子有关。因此在滴定过程中,B+逐渐减少而被C+所代替。溶液的电导改变有以下几种情况:
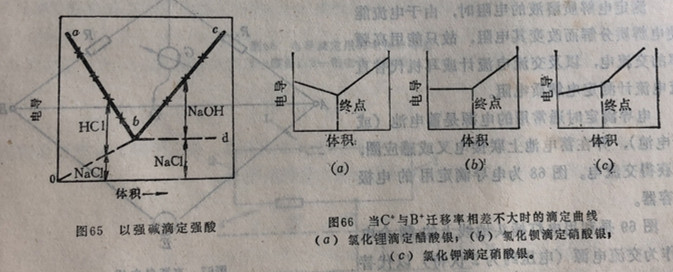
(1)迁移率B+>C+,则则AB溶液的电导随着试剂CD的加入而逐渐减小。滴定终点时,溶液的电导最小;过了终点由于过量试剂的加入溶液的电导又继续上升。把每加一次试剂测得溶液的电导的结果绘成曲线(图65),即可看出溶液的最低电导点即为滴定终点(一般以强碱滴定强酸或以强酸滴强碱就属于这种情况)。
(2)若迁移率B等于C或相差较小,则在滴定中溶液电导改变较小。到终点后,由于过量试剂的加入溶液电导升高较快,所得滴定曲线如图66所示。
从图66得知,以测定溶液的电导绘出的电导曲线,一般包括二条直线,其交叉点即为滴定终点。
电导滴定和电位滴定不同。对电位滴定而言,终点附近的数据是最重要的,但电导滴定终点附近的数据并无多大意义。由于所生沉淀的溶解、所生弱酸的离解以及所生成盐类的水解等原因,在终点附近所得到的读数并不可靠。因此,用远离滴定终点所得数据作图推算反而准确,这是电导滴定的特殊优点。因为这样,电位滴定法或指示剂滴定法所不能解决的问题,电导滴定法或有可能求得相当准确的结果。但由于不起反应的离子影响电导滴定的准确度,所以电导滴定的应用范围较狭窄。
在最合适条件下,电导滴定的精确度约为0.5~1%
