
















(1)滴定至当点的定位法
该方法所用参考电极或补偿电极见图59。在容器H里内所装的溶液为终点溶液,其组成与试样溶液滴到终点时的组成完全一样。因此,将补偿电极和金属指示电极浸入试样溶液,到滴定终点时,两电极电位相等,溶液中无电流通过。
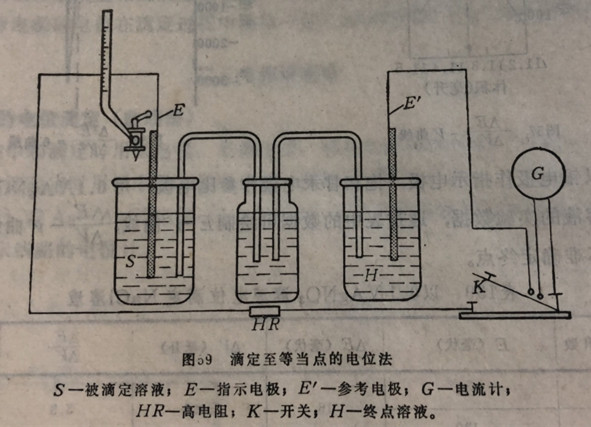
开始滴定时,因补偿电极内外溶液的组成不同,电极电位发生差别,使电流计指针偏转。当到达等当点时,电位差为零,指针回零。若过量一滴,则指针便越过零位置(反方向)。
用这种方法数分钟内即可得结果,但对于每一种滴定,必须配制一对完全相同的补偿电极。
(2)在不补偿偿的情况下测定电位的方法
将铂极和钨极同时插入被测溶液中,如图60所示。以滴入滴定剂测出对应电流计的偏转:开始时指针偏转较小,应继续滴定直至指针偏转较大或突然跳动,即为终点。过终点后偏转变小,以电流计读数为纵坐标,以滴定剂毫升数为横坐标作Eー图,确定终点。虽然这种方法用的是电流计,但实际上测量的是两极电位差。这种电位差的测定,未采用补偿法,看来会造成严重误差。但实际上,因线路中引入了高电阻,使两电极的电位差所产生的电流极微弱,所以没有显著改变电极电位。

(3)浓差滴定法
将两个相同电极(如两根铂丝)置于被测溶液中,一极用一玻璃套遮住,见图61(a),此套可上下移动。当套移上时,电极旁边溶液的浓度与另一极完全相同,两极上没有电位差;将套移下遮蔽电极时,.加试剂于溶液中,由于扩散作用被限制,两极上溶液浓度有差别,因此两极电位不同。每加一次试剂,用电位计测定两极间的电位差,再将玻璃套升起,使溶液均匀混合,两校电位差即复归于零,再放下玻璃套加入试剂。未到终点前,两极间的电位差很小;当达到终点时,加一滴试剂电位改变很大,因而两极电位差也很大。若以电位差与试剂体积绘制一曲线,则曲线最高点即表示终点。
.jpg) 图61(b),利用眼药滴管,一极在管内,一极在管外。压缩橡皮帽可将管内溶液压出和外面溶液相混合,而使两极电位相等。不用电位计,可用高电阻与灵敏电流计来测出终点。
图61(b),利用眼药滴管,一极在管内,一极在管外。压缩橡皮帽可将管内溶液压出和外面溶液相混合,而使两极电位相等。不用电位计,可用高电阻与灵敏电流计来测出终点。
(4)“死停”终点法
以碘溶液滴定硫代硫酸钠溶液来说明这种电位滴定法:滴定时,将两个相同铂镍电极浸在氧化还原滴定溶速液中,并在两电极上加以10~15毫伏特电压(如图62所示)。若溶液的电极作用是不可逆的,如S2O32-→S4O62-,则此时有很小电流或全无电流通过。当滴入的碘溶液过
等当点后,溶液中有过量的碘存在,而I2<=>2I-的电极作用是可逆的,因此溶液中就有电流通过,电流计的指针突然偏转,不再回复;反之,在碘溶液中滴入硫代硫酸钠溶液,滴定开始时,电流计显示偏转,一到等当点后,碘全部被还原,即无电流通过,电流计回至零点,即使加入过量硫代硫酸钠,因S2032-→S4O62-不可逆,电流计指针仍停在零点,故称“死停”终点法。
