

























电化学分析主要是研究物质的化学成分与它的电化学性质间的关系。应用电化学的研究成果来解决分析化学方面的问题,已发展成多种的电化学分析方法。在这些方法中,如电位滴定法、电导滴定法和极谱滴定法,基本上是利用滴定过程中被测溶液的电的性质(电位,电导和电流)改变来指示滴定终点,称为电容量分析法;各种电解法,基本上是利用电能从溶液中使被测定的元素在已知重量的电极上被还原为金属析出,然后测其重量。该法称为电重量分析法。极谱分析是电化学分析之一,但理论上和实验技术方面都与上述两类方法不同,可视为一种特殊的电解分析法。
当一种金属浸在含有该金属离子的溶液中时,在金属和溶液间便产生一个电位差,称为电极电位。这个电位的绝对值现在还无法测定。但是,我们可以测定浸在同一溶液中的两个电极间的电位差。设在任一温度时,当量氢电极(氢离子活度为1,氢的气压为一个大气压)的电位为零,那么任何其他电极的电位都可根据这个当量氢电极为标准来测定。在25℃时,与自己离子相接触的金属电极电位E,可用勒恩斯特方程式表示:
RT
E = E0+——log[Me(n+)]
nF
式中 E0——标准电位;
[Me(n+)]——金属离子浓度(更正确地说是活度);
R——8.315伏一库仑或焦耳;
F——96500库仑;
T——绝对温度(°K);
n——离子的价数。
在25C时:
0.0591
E = E0+————log[Me(n+)] (1)
n
若以离子的指数pMe(n+)[pMe(n+)=-log[Me(n+)]]代入(1)式得:
0.0591
E = E0 - ———— [pMe(n+)] (2)
n
表示氢电极时为:
E = E0-0.0591pH (3)
将贵金属铂(或钯或金电极)浸于氧化还原系统的溶液中,则铂电极电位E(以当量氢电极为标准)在25℃时为:
0.591 [ox]
E = E0+———log ——— (1)
n [Red]
式中 n——电子得失数;
[OX]——氧化态浓度;
[Red]——还原态浓度。
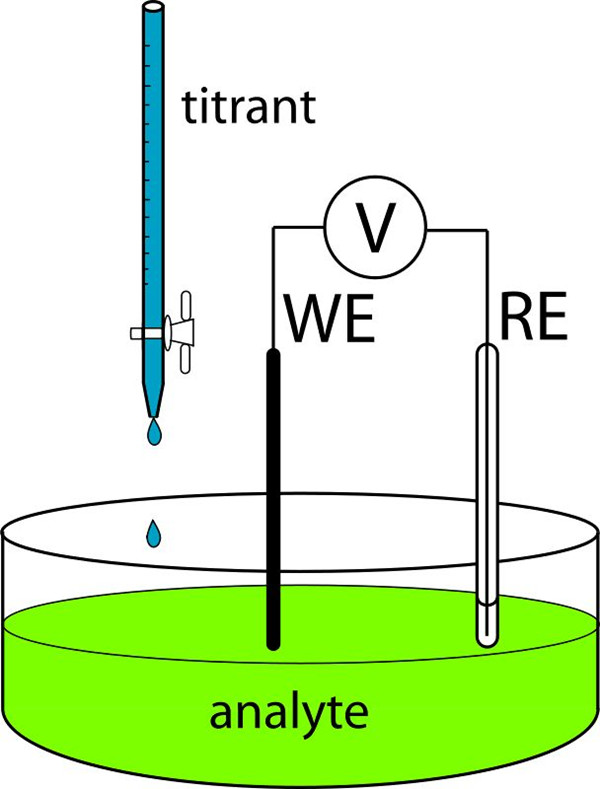
当其他条件一定,铂电极电位与溶液中的离子浓度或氧化形还原形浓度之间,存在着简单的关系,即铂电极电位随溶液组成的变化而变化。在电位滴定中,反映滴定过程中溶液组成的变化的电极称为指示电极;电极电位不随溶液组成变化的电极称为参考电极。
在电位滴定时,把指示电极浸在被测溶液内,将参考电极浸在同一溶液中或借盐桥与该溶液相接触,然后用电位计测量指示电极与参考电极间的电动势。随滴定过程中溶液中离子浓度的变化,电动势也发生相应变化,在滴定终点时,离子浓度或氧化形还原形的浓度急剧变化,电动势也发生相应的急剧变化,形成突跃,利用电位突跃从而客观地找出滴定终点(因参考电极的电位在滴定过程中保持一定,故所测电动势即为指示电极电位)。
