金属当量的测定
化学试剂,九料化工商城 / 2020-10-20
一、金属当量的测定实验目的
1.了解用置换法测定金属当量的方法;
2.利用气体状态方程式和分压定律进行有关计算;
3.学习量气管和气压计的使用方法。
二、提要
本实验中用置换法测定金属镁的当量。将已知重量的镁与过量的稀酸作用,用排水集气法量被置换出氢气的体积,并利用气体状态方程式计算氢气的重量:
WH2
PH2V= -------- RT
MG
式中,PH2一氢气的压力(毫米汞柱);
V—置换出氢气的体积(毫升)
WH2—置换出氢气的重量(克);
MG—氢气的摩尔质量(克·摩-1);
T—氢气的温度(开);
R—摩尔气体常数(62400毫升·毫米汞柱·开-1·摩-1)。
由于在量气管内收集的氢气是被水蒸气所饱和的,根据分压定律,量气管内的气压(P)等于大气压力)是氢气的分压(pH2)与实验温度(t℃)时饱和水蒸气的分压(PH2O)的总和,即
P=PH2+PH2O, PH2=P-PH2O
MG(P-PH2O)V
WH2=-------------------
R(273+t)
最后根据当量定律,从置换出氢气的重量(克)计算该金属的当量:
W WH2 W
---- = ------- E=--------- .EH2
H EH2 WH2
式中, W—金属的重量(克)
E—金属的当量;
EH2一氢气的当量。
三、仪器和药品
1.仪器
测定金属当量的仪器装置(量气管[注1]\水准瓶[注2]\试管\滴定管夹\铁夹\铁圈\橡皮塞\橡皮管\导气管)量筒(10ml)长颈漏斗\温度计\气压计(公用)
[注1]量气管的容量不应小于50毫升,读数可估计到0.01(或0.02)毫升,可用滴定管代替。
[注2]水准瓶可用量气管,为简化仪器起见,本实验中用漏斗代替。
2.药品
硫酸H2SO4(2N)
镁条(纯)[注]
[注]也可用铝片或锌片代替镁条;用盐酸代替硫酸。
四、实验内容
1.仪器的装置和检查
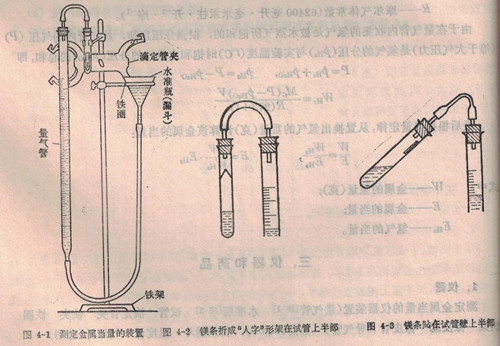
按图4-1装置仪器,注意将铁圈装在滴定管夹的下面以便可以移动水准瓶(漏斗)。取下量气管的橡皮塞,从水准瓶注入自来水,使量气管内液面略低于刻度零。
为了准确量出生成氢气的体积,整个装置不可有漏气的地方。检查漏气的方法如下:塞紧装置中连接处的橡皮塞,然后将水准瓶向下或向上)移动一段距离,使水准瓶内液面低于(或高于)量气管内液面。若水准瓶固定后,量气管内液面仍不断下降(或上升),表示装置漏气,则应检查各连接处(注意橡皮塞是否紧密),予以纠正。如果装置不漏气,即可将水准瓶放到原来位置上。
2.金属与稀酸作用前的准备
取下试管,用量筒(10ml)量取约4ml2 NH2SO4,通过长颈漏斗注入试管中(使H2SO4不致流过试管的上半部),把试管略为倾斜,将一已知重量(不要忘了将这重量值记在报告上)的镁条[注]折成“人字”形架在试管上半部,如图4-2所示(或蘸少许水后,贴在试管壁上半部,如图4-3所示),确保镁条不与硫酸接触。然后小心地固定试管,塞紧橡皮塞(动作小心!慎防镁条酸中)。此时必须再检查一次是否漏气。若不漏气,则调整水准瓶的位置,使量气管内液面与水准瓶内液面在同一水平面上。然后准确读出量气管内液面的弯月面底部所在的位置(至小数点后两位数字)。将读数记下。
[注]最好用实验三中学生自已称重的镁条。若用50ml量气管,镁条重量应在0.0300~0.0400克之间。
3.氢气的发生、收集和体积的量度
松开夹子,稍稍提高试管底部,使稀酸与镁条作用;待镁条落入酸中后,再将试管放回原处,此时量气管内液面开始下降。为了不使量气管内气压增加而造成漏气,在液面下降的同时应慢慢地向下移动水准瓶,使水准瓶内液面随量气管内液面一齐下降,直到量气管内液面停止上下降时,可将水准瓶固定,随即摸一下试管底部。(有何感觉?)待试管冷却至室温(约十几分钟,再移动水准瓶,使两液面处于同一水平面上,读出量气管内液面所在的位置。然后每隔2-分钟,读数一次,直到读数不变为止。将最后读数记下,再记录当时的室温及大气压力,
从附录三查出此室温时水的饱和蒸气压,计算镁的当量及实验测定的误差。
五、实验前准备的思考题
1.本实验中置换出的氢气的体积是怎样量度的?为什么读数时必须使水准瓶内液面与量气内液面保持在同一水平面上?
2.量气管内气体的体积是否等于置换出氢气的体积?量气管内气体的压力是否等于氢气的压力?
4.在镁与稀酸作用完毕后,为什么要等试管冷却到室温时方可读数?