

中和反应时除了要知道指示剂的实质外,还必须了解中和滴定时pH值的变化情况,即被测物浓度的变化,特别是在等当点附近由于加入一滴酸或碱所引起的pH值变化。酸碱溶液的强弱不同,所引起pH值的变化也不同。各类型的pH值的的变化,通常用曲线较形象地表示,这种曲线就叫滴定曲线。下面分别作一介绍:
例如用0.1NV的氢氧化钠溶液滴定20.00毫升0.1NV的盐酸时,pH值变化情况可分四个阶段来考虑。其计算根据据是:N1V1=N2V2
(1)未滴定前溶液的pH值
因氢氧化钠未加入,故溶液的pH值决定于盐酸溶液的浓度。即
[H+] = 0.1000克离子/升
PH = 1..0
(2)滴定开始至等当点前溶液的pH值
随着氢氧化钠的加入,溶液中氢离子浓度亦随之改变。这时溶液的pH值取决于剩余盐酸量,但应考虑加入碱量所引起的溶液体积的改变。
a.当90%的盐酸被中和,只剩下2毫升0.1N盐酸,滴入0.1N氢氧化钠体积恰为18.00毫升,这时溶液的总体积为20.00+18.00=38.00毫升,氢离子浓度和pH值决定于中和后盐酸的浓度。
38.00×N=0.1×2.00
0.1×2.00
N=—————— = 0.005
38.00
[H+]=0.005克离子/升
故 pH = 2.3
b.当99%的盐酸被中和,剩余0.20毫升盐酸,滴入0.1N氢氧化钠为19.80毫升,此时溶液中氢离子浓度和pH值分别为:
0.2
[H+]= ———————— ×0.1=5×10 -4次方
20.00+19.80
pH = 3.3
同理可算出,当99.9%的盐酸被中和,加入碱量19.98毫升,溶液的phH为4.3。此时只差0.02毫开氢氧化钠就到达等当点。
(3)等当点时溶液的pH值
等当点时,已滴入20.00毫升氢氧化钠,盐盐酸全部被中和,溶液呈中性。此时pH值决定于水的电离。即
[H+]=[OH-]=根号10 -14次方=10 -7次方
故pH=7
(4)等当点后溶液的pH值
此时,溶液是由氢氧化钠和氯化钠组成,其pH值仅由过量的氢氧化钠浓度来决定,即
过量NaOH体积
[OH-]=0.1×————————
溶液总体积
pH = 14-pOH
如:当滴入氢氧化钠溶液20.02毫升(即过量0.02毫升)时:
0.02
[OH-]= 0.1×——————— = 5×10 -5次方
20.00+20.02
同理可计算:
加入NaOH20.20毫升时,溶液pH=10.7
加入NaOH22.00毫升时,溶液pH=11.7
加入NaOH40.00毫升时,溶液pH=12.5
将以上数据整理列于表16中
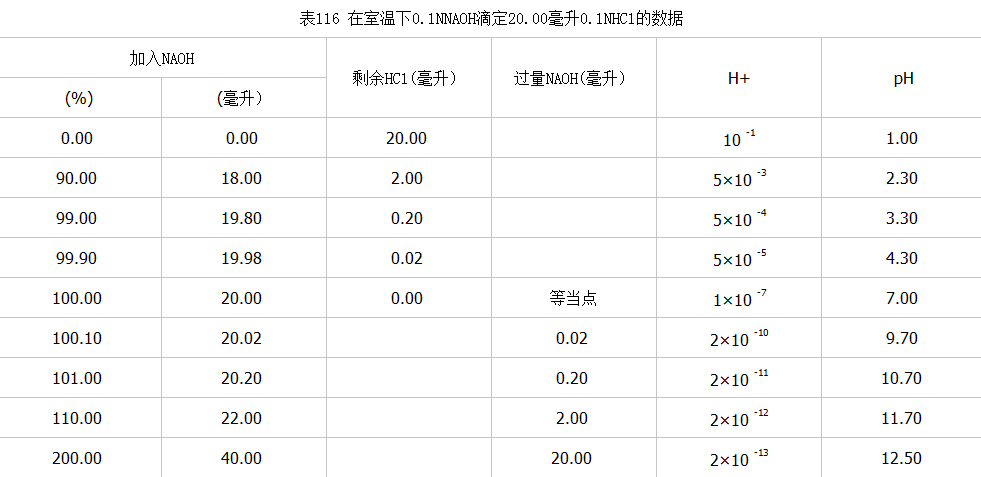
根据上表数据绘出滴定曲线,见图39
从滴定曲线可看出:
(1)等当点时pH=7
(2)等当点前后,从剩余0.02毫升盐酸到过量0.02毫升氢氧化钠,即氢氧化钠从不足到过量,仅差0,04毫升(约1滴),而溶液中pH值从4.30增加到9.70,变化5.4个单位,形成滴定曲线部份。
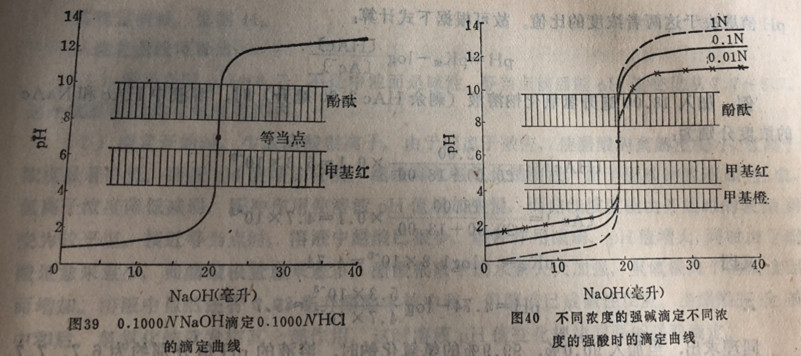
(3)选择滴定时所用的指示剂,主要是以滴定曲线的pH值突跃范围为依据的。最理想的指示剂应恰好在等当点时变色。但实际上,凡是变色点在突跃范围(pH4.3~9.7)以内的指示剂都可以指示终点,都能达到精度要求。若在pH为9.7时结束滴定,即氢氧化钠过量0.02毫升(半滴),所带来的滴定误差仅为:
±0.02
———— ×100 = +0.1%
20.00
如果在pH小于9.7而大于4.3时结束滴定,误差将小于0,1%。因此,甲基红、酚酞、甲基橙(酸滴碱)、溴百里酚蓝、中性红、苯酚红、石蕊等指示剂均适用。
必须指出:滴定曲线突跃范围的大小与酸碱的浓度有关,见见图40。
从曲线中看出:盐酸和氢氧化钠溶液均为1.000NV时,突跃范围为pH=3.3~10.7;其浓度为0.01W时,突跃范围则变为pH=5.3~8.7。这是因为氢氧化钠和盐酸的浓度愈大则最后滴溶液所含溶质的量就愈多,所引起pH值改变也越大,相应滴定误差也较大。反之pH值的突跃范围就大大缩小。酸碱溶液浓度相差10倍时,pH值突跃范围就相差2个单位。在选择指示剂时必须注意这个问题。溶液浓度太小时,pH值突跃范围不明显,引起滴定误差亦大,并且无适合的指示剂。故在定量分析中,常用标准溶液的浓度为0.05~0.5N.