(一)指示剂变色原理
酸碱指示剂多系有机弱酸(HIn)、弱弱碱(InOH)或两性物质。其分子和离子具有有不同的颜色,在溶液中存在着以下的电离平衡:
HIN(分子色)<=(OH-)(H+)=>H+IN-(离子色)
在氢离子和氢氧离子的作用下,平衡引起移动,同时发生了结构变化,因而使溶液呈现不同的颜色。
以酚酞为例,它是一种有机弱酸:
style="width: 499px; height: 251px;" alt="" />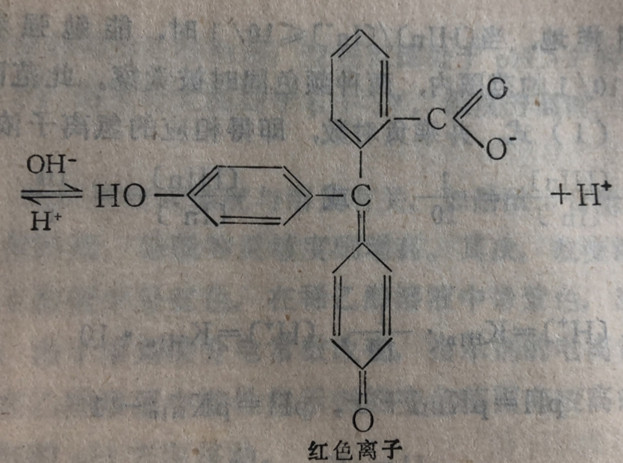
在酸性溶液中,平衡向左移动,生成无色的酚酞分子;在碱性溶液中,平衡则向右移动,它从无色的分子改变为具有红色的醌式结构的酚酞分子,继而又电离为具有醌式结构的红色离子。由此可见,指示剂的结构是颜色变化的根据(内因),溶液pH值的改变是颜色变化的条件(外因)。“外因通过内因而起作用”。
color: rgb(255, 0, 0); font-size: 18px;">酚酞的碱态是不稳的,经长期放置后(或与浓碱作用时),它会慢慢地转变成甲醇式的无色三价离子,其结构如下所示:(二)指示剂的变色范围
不同的指示剂有不同的变色范围,各种指示剂在溶液中均可电离,在一定的温度条件下,都有它的电离常数(KHa或K1ao)或称指示剂常数。它们的电离平衡关系以通式表示:
[H+][IN-]
————— = Khin
[HON]
[HIN]
则 [H+]= ———— ·Khin (1)
[IN-]
由此可知指示剂的变色由[HIn]/[In-]比值决定,而氢离子浓度又取决于[HIn]/[In-]的比值,故指示剂剂的变色则取决于溶液中的pH值。
当氢离子浓度等于该指示剂的电离常数时,即指示剂在溶液中的分子浓度和其离子浓度正好相等等,亦即分子型的颜色和离子型的颜色各占一半,溶液呈现混合色(或过渡色)。此时的pH值就是指示剂开始变色的酸度,该点为指示剂的变色点(从理论上讲,此时即应结束滴定,实际上肉眼观察不到颜色的改变)。
由于眼睛对颜色的观察是不够灵敏的,一般来讲当[HIn]/[In-]≥1/10时,方能勉强看到HIn的颜色;,同同样地,当[HIn]/[In-]≤10(1时,能能勉强看到In的颜色。在[HIn]/[In-]=1/10~10/1的范围内,两两种颜色同时被觉察。此范围称为该指示剂的变
色范围。把此范围代入(1)式,并乘负负对数,即得相应的氢离子浓度和pH值。即
[HIN] 1 [HIN] 10
当 ———— = —— 或 ———— = ——
[IN-] 10 [IN-] 1
代入(1)式得;
[H+]=Khin·1/10,[H+]=Khin·10
则 : pH=pKhin+1,pH=pKhin-1
因此, pH=Khin±1 (2)
(2)式就是指示剂变色的pH范围(见附表120)。由由于视力对颜色的识别能力不同(如红色在无色中特别明显,无色在红色中就不易观察出来),不少指示剂的变色理论值,是在pH= PKHIN±0.3~1.4之间,主要就是这个原因(当然还有其它因素)。如甲基橙的变色范围为pH=3.1~4.4,即在pH=3.1~4.4之间可以同时看到红、黄两种不同的颜色(不同程度的橙色)
pH<3.1纯红色
pH>3.1红色中有黄色} 不同程度的橙色
pH≤4.4黄色中有红色} 不同程度的橙色
pH>4.4纯黄色
因此中和滴定选用酚酞指示剂时;应尽可能用碱滴酸;选用甲基橙指示剂时,则用酸滴碱。
由于各种指示剂的电离常数不同,其变色范围的pH值也不同。其规律是:电离常数大的指示剂在pH值较小时变色(如甲基橙KHin=3×10 -4次方,变色范围3.1~4.4),电离常数小的指示剂则在pH值较大时变色(如酚酞K1n4×10 -10次方,变色范围为8.0~10.0)。一般来说,指示剂的变色范围不大于两个pH值,也不小于一个pH值(石蕊例外)。
(三)混合指指示剂
为减小指示剂的变位范围,使过渡色消失或减少,常采用混合指宗剂。它比单一指示剂优越。如如甲基红与次甲基蓝混合指示剂,在酸性溶液中为紫色,碱性溶液中为绿色,变色非常明显,甚至在灯光下也很容易观察。
混合指示剂是由人工配制而成,一般是几种指示剂的混合物或指示剂与染料的混合物,适当的混合比例是能否达到预期效果的关键。

(四)影响指示剂变色范围的几种因素
(1)指示剂浓度的影响:指示剂浓度改变会导致变色范围移动,故指示剂的用量直接影响滴定的准确度。用量太少起不到指示等当点的作用,太多会使结果造成误差。由于指示剂本身也能消耗酸或碱,同时会加深溶液颜色,因而终点不易观察。
(2)盐类的影响:盐类的存在会影响指示剂颜色的深度和指示剂的电离常数,因而移动其变色范围。一般说当溶液中存在盐类时,酸性指示剂变色范围移向碱性(即pH较高)碱性指示剂的变色范围移向酸性。
(3)温度的影响:温度的改变,使指示剂及水的电离常数都受到影响,尤其后者变化显著。一般说来,它对变色范围的影响是:变色范围处于pH>7的指示剂,温度升高变色范围移向碱性更大的一方,而变色范围处于pH<7,温度升高时,其变色范围则移向酸性更大的一方。
(4)溶剂的影响:指示剂的灵敏度与溶剂有关,如酚酞、百里酚酞、甲基橙等在醇溶液中灵敏度则降低,溴酚蓝、硝胺胺等灵敏度则增高。其次,改变溶剂,指示剂颜色也发生改变。如酚酞在碱性水溶液中呈红色,在稀乙醇溶液中带紫色,浓乙醇溶液中则呈蓝紫色。同时当溶剂改变时,由于溶剂的介电常数改变,指示剂的电离常数也改变,其变色范围亦跟着发生移动。如在乙醇溶液中酸性指示剂的变色范围向较高的pH方向移动,碱碱性指示剂的变色范围向较低的pH方向移动。
(5)胶体的影影响:胶体与指示剂的离子形成络合物,从而影响指示剂颜色的深度,并改变产生变色的范围。