










在化学分析过程中,不管采用何种分析方法,都都需要控制定的酸度值pH。例如在重量分析中,控制一定的pH值,并利用某些元素生成沉淀的溶度积不同,可使元素相分离。络合滴定时,也必须控制一定的pH值;比色分析中,显色反应大多是在一定的pH值时才能反应完全。通常是在溶液中加入缓冲溶液来控制pH值。

溶液的pH值水是一种种弱电解质,离解成氢离子和氢氧离子
H2O<=>H++OH-
根据质量作用定律得
[h+][oh-]
Ki= ——————
[h2o]
因为水的离解度极小,离解耗去的水并不影响实际浓度,所以H2O实际上不变,为一常数。所以
Kh2o=Ki[H2O]=[K+][OH-]
因此在任何水溶液中,一定温度下的氢离子克分子浓度和氢氧离子克分子浓度之积为一常数。此常数称为水的离子积常数。
即 [H+][OH-]=Kw
而纯水的电导率(一立方厘米电导)为5.54×108欧姆:厘米。所所以1000立方厘米的电导等于1000X5.54×108姆欧,等于5.54×10-5次方姆欧。在同温度无限稀释溶液中,Ht和OH的当量电导是349.8和198.5姆欧,如果一升水中有一当量H和一当量OH,则一升水的电导为349.8+198.5=548.3姆欧。
∴ 548.3×[h+]=5.54×10 -5次方
∴ [H+]=1.2×10 -7次方
纯水中氢离子和氢氧离子的浓度相等
∴ 在25℃时,水离子积常数为
[H+][OH-]=Kw=1.0×10 -14次方
在纯水中加入少许氢氧化钠,如[oh-]浓度由10 -7M变为10 -5M时,则
1×10 -14次方M
[H+]= ————————=10 -9次方M
10 -5次方M
反之在纯水中加入少量酸,如〔H+〕浓度由10 -7M变为10 -4M时,则
1×10 -14次方M
[OH-]= ————————=10 -10次方M
10 -4次方M
即溶液呈碱性时,溶液的[OH-]浓度>10 -7次方M,[h+]浓度<10 -7M。溶液呈酸性时,溶液的[h+]浓度>10 -7M,[oh-]浓度<10 -7M。
因此,溶液是酸性,中性或碱性,可以用溶液中氢离子或氢氧离子浓度来表示。

用氢离子或氢氧离子的浓度来表示溶液的酸碱性,在计算或应用方面都很不方便。在分析化学上用pH或pOH值表示就方便多了。
因此
PH=-log[h+]
pOH=-log[oh-]
纯水的pH=7,酸性溶液的pH<7,碱性溶液液的pH>7
纯水的pOH=7,酸性溶液的pOH>7,碱性溶液的pOH<7。
在同一溶液中,pH+pOH=14,而日常应用上只采用pH表示溶液的酸碱性。
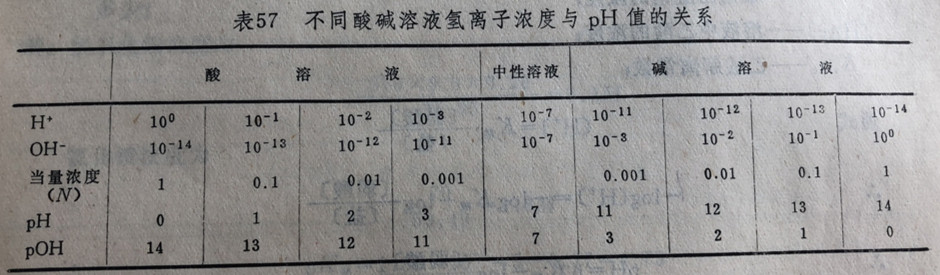
如上表是不同酸碱溶液氢离子浓度与pH值的关系。
