通式为MX的离子型化合物往往结晶成下列三种结构之一氯化铯(CsC1)结构、氯化钠(NaC1)结构和闪锌矿(乙nS)结构。这些结构都是立方晶格并表示在图11-11中。
从氯化铯模型可以看到一个铯离子占据在立方体的中心并有八个氯离子作为它的最近邻。氯离子在实际上都同中心铯离子相接触。在晶体中ー个原子或离子的最近邻的数目叫做配位数。在配位化合物中配位数这个词略有不同的意义(第32.1节)]。每个氯离子也占据在一个立方体的中心上(在图11-11中中没有表示出来),这个立方体以铯离子占据在角顶上而构成,使每个氯离子的配位数也是八。由于在伸展的晶格中每个角顶上的离子是被八个 立方体所共用,所以每个氯化铯单元晶胞在它的中心含有一个铯离子和净含一个角顶氯离子(8x、)。每个单元晶胞有一个Cs+和一个C1而保持了电中性。
研究氯化钠结构可以看到,中心离子(钠)有六个氯离子作为最近邻,占据在一个正八面体的角顶上,因此配位数为六。每个单元晶胞中含有四个钠离子和四个氯离子使晶胞为电中性。
在闪锌矿(ZnS)结构中的锌离子有四个硫离子作为最近邻占据在正四面体的角顶上。注意在这种结构中仅交替的四面体孔穴被锌离子所占据。每个单元晶胞中有四个锌离子和四个硫离子,使单元晶胞保持电中性。
如前所述,一种给定的MX型离子化合物所采取的结构主要是筒单几何关系和静电关系的结果,并决定于正离子(阳离子)和负离子(阴离子)的相对大小。一个大的阳离子可以在它的周围有较多的阴离子,但和小阳离子相比仍使阴离子保持一定的距离。换句话说,晶体结构和结果的配位数不仅决定于电中性的需要而且也决定于离子的相对大小。每种排列的极限结构可以用所含离子的半径比来表示
阳离子半径 r+
半径比=—————— = ——
阴离子半径 r-
对任何配位数来说都有一个最小的(r/r)比值,低于这个比值时阴离子就将彼此相接触。MX型化合物半径比的近似极限值提供在表11-4中。
具有氯化铯结构的一些盐和它们的实际半径比如下:CsC1(0.93);CsBr(0.87);CsI(0.78)和T1C1(0.83)。NaC1结构:NaC1(0.52);NaI(0.44);KC1(0.73)AgC1(0.70)。ZnS结构:ZnS(0.40);ZnSe(0.37);BeO(0.22)。
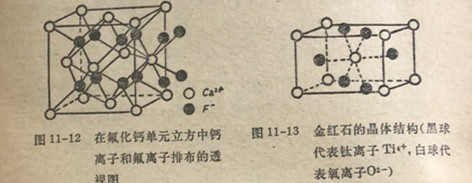
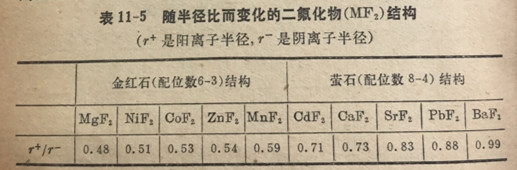
通式为MX2的离子型化合物往往结晶成如下两种结构之一:萤石(CaF2)晶格和金红石(TiO2)晶格(见图11-12和11-13)。这些结构中最重要的单一特征还是配位数。对MX2型化合物来说,阳离子的配位数和阴离子的配位数是不同的,因为X-离子是M2+离子的2倍。在CaF2晶体中,Ca2+的配位数是八,而F~的配位数是四。在金红石中,钛和氧离子的配位数分别是六和三。
在表11-5中提供了一系列二氟化物MF2的rt/ァ-值,所有这些晶体结构的实验测定表明它们可以照表中所指出的那样分类。注意当r+/r降到低于0.71时晶体就从配位数为八的结构变为配位数为六的结构。
于是,离子型晶体的结构显然将决定于离子的相对数目和相对大小。半径比规则只能严格地应用于离子型晶体。在共价键占主导地位的化合物中这个规则不适用于预测结构。