





大多数固体物质在本质上是晶状的。虽然某些固体有如糖和食盐是由单晶组成,它们的形状我们是熟悉的,但我们日常接触到的大多数晶状固体是许多交错在一起的小晶体的聚集体。后者的常见例子是冰块和金属制品。晶体可以定义为具有天然多面体外形的均相物体。晶体是由晶面包起来的三维固体。对一种给定的物质来说晶面的交角总是不变的,并且是该物质的特征。图11-7介绍了氯化钠、金属铜和方解石( Caco3)单晶的外形。
对晶体的x一射线衍射线研究发现每种晶体都是由原子、分子或离子以三维图形的的排列组成,这种三维图形在整个晶体中有规律地一再重复出现。各种物质的晶体都是按照一定几何何图形建造起来的,这种几何图形叫做晶格。晶格中含有晶体结构中具有代表性的最小部分叫做单元晶胞。单元晶胞在三维空间里无限重复就呈现成晶体。因此,固体的性质就由单元晶胞的大小、形状和内容所决定的。单元晶胞是一种平行多边体,它的大小和形状由三根轴的长度(a、b、c)和轴间夹角(a、B、7)所确定(图11-8)。

已知晶体的单元晶胞可以分为七类:
立方晶系a=b=c a=B=y=90° 岩盐(NaC1)
四方晶系a=b≠c a=B=y=90° 白锡
正交晶系a≠b≠C a=B=y=90° 氯化汞(Ⅱ)
单斜晶系≠b≠c a=y=90° B÷90° 氯酸钾
三斜晶系a≠b≠c a≠B≠y≠90° 重铬酸钾
六方晶系a=b≠c a=B=90° y=120° 硅石(SiO2)
三方晶系a=b=c a=B=y≠90° 方解解石(CaCo3)
七类单元晶胞发生变异产生十四种晶格有如图11-9所示。这
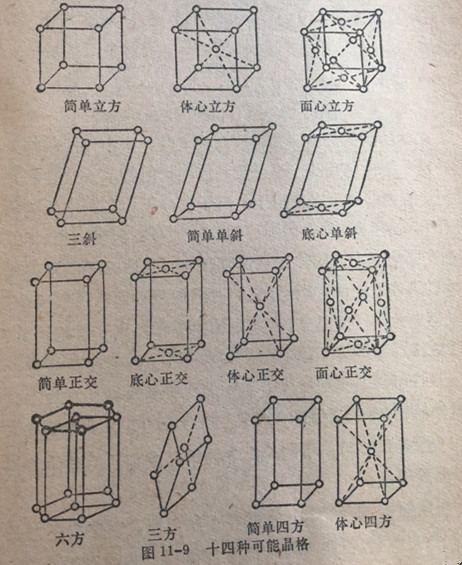
些晶格中前三种晶格的结构单元堆积形式绘示在图11-10中。如果一种晶胞在它的中心上含有与在角顶上为同种类的原子,则这种晶胞叫做体心晶格。如果单元晶胞在棱面的中点上含有与角顶上为同种类的原子,这种晶胞叫做面心晶格。
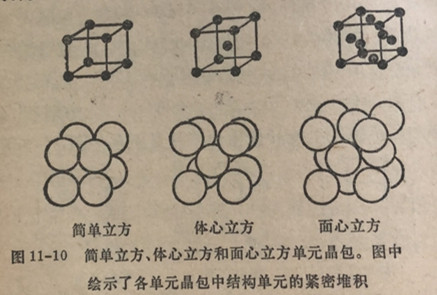
晶格的结构是由许多种因素决定的。其中包括结构单元的相对数目和结构单元的大小以及晶体中把结构单元结合起来的价键类型。结构单元可以是原子、离子或分子。在铜中的结构单元是铜原子,它们以有规律的图形(面心立方)堆积在一起,并以铜原子占据在晶格点上。固体二氧化碳(干冰)是由分子晶体组成的,在其中CO2分子是单元质点;它们占据在面心立方晶格的位置上。氯化钠形成为离子型晶体,在其中钠离子和氯离子是结构单元(图11-11)。硝酸铵晶体以NH4+和NO3占据在晶格位置上。
NaF、KCl、RbBr、MgO和CdS等晶体都具有与NaCl相同的晶体结构;SrCl2、CdF2、PbF2、ZrO和ThO2都结晶成CaF2的
结构(见图11-12)。不同的化合物结晶成相同的晶体结构的现象叫微类质同晶。
当碳酸钙(CaCO3)在低温下结晶时,它采取三方晶系的晶格,叫做方解石,但在高温结晶时却得到正交晶系的晶格,这种物质叫做文石。同一种物质采取两种或多种晶体结构的现象叫做同质多晶现象。方解石和文石都是由钙离子和碳酸根离子组成的,但是在这两种晶体中这些离子是以不同方式而排列的。
