研究一下表11-1和图11-3,我们将看到,在给定温度下,乙飇的蒸气压大于乙醇,乙醇的蒸气压大于水。蒸气压的这些差别同分子间引力有关,在这三种物质中,乙醚的分子间引力最小,水的分子间引力最大。因此液体的平衡蒸气压决定于组成液体的分子的特定类别。

表11-1和图11-3中的数据表明这三种液体的蒸气压随温度升高而增加。的确,这种情况对所有的液体都是真实的,因为随着温度的升高分子的运动速度增大。这就导致在单位时间内有较多的分子能以较大的速度从液面逸出。这些都有助于产生较高的平衡蒸气压。
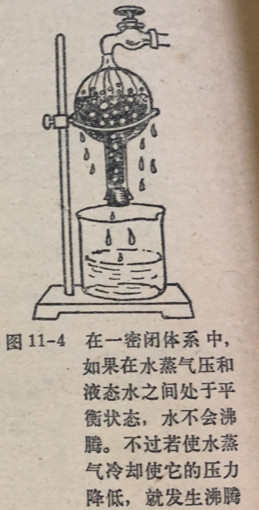
当在液体内形成气泡并升到液面爆开并放出蒸气时,我们说液体沸腾了。曝置在大气中的液体当它的平衡蒸气压等于大气压时它就沸腾了。一种液体的正常沸点就是它的平衡蒸气压恰好等于标谁大气压760毫米时的温度(图11-3)。当外界压力大于ー个大气压时液体可在高于正常沸点的温度时沸腾,反之,将液面上的压力降低到低于一大气压时(图11-4)液体的沸点可以低于正常沸点。因此在高山上,那里的大气压低于760毫米,水在低于正常沸点100°0的温度时沸腾。在高山上在沸水中煮食物要熟的比较缓慢,因为
沸水的温度低于接近海平面沸水的温度。图1-4在一密闭体系中,在高压锅中沸水的温度高于正常沸点,因为它有较高的平衡蒸气压,因此用它煮食物比在散口器皿中煮食物熟得快。