







电负性这个术语已定义为种原子对它外层电子吸引力的衡量尺度。许多元素的电负性值已提供在表4-2中,一个原子的电负性一般和它的电离势与电子亲合势有关。事实上,化学物理学家密立根(R.S.Mul1iken)曾经建议,原子的电离势和电子亲合势的平均值应该是它电负性的种合适的衡量尺度。电负性大的元素出现在每一周期的末尾;它们都是电离势大和电子亲合势大的非金属元素。那些电正性最大元素,即电负性小(小的电离势和接近零的电子亲合势)的元素出现于周期的开始。它们是碱金属和碱土金属元素。在周期中间的元素,它们的电负性在数值上介于中间。在族中从上向下,下边的元素具有低的电负性(参见表4-2)。
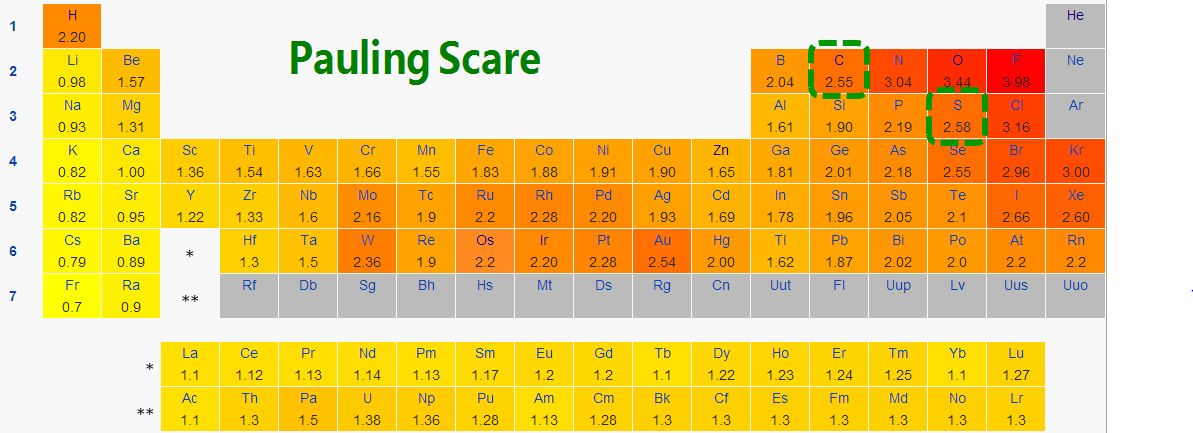
当两个成键原子之间电负性有大的差值时,生成的键容易显离子性。在LiF、NaCl、K2O、Li3N和CsBr中就有这种情况,电负性的差值是2或更大些。电负性差值小的原子之间的键在性质上主要是共价键。在CO2、CCl412O、NI、ICl、NO和BN就有
这种情况。于是当周期表最左端的元素同周期表最右端的元素反应生成的键主要是离子键,而在周期表中相邻近的元素互相反应生成的键主要是共价键。