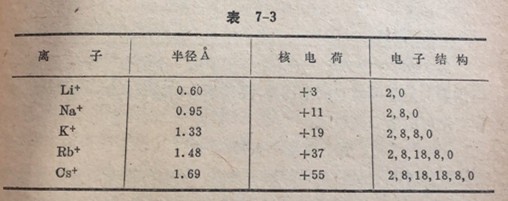
正离子的半径比它的母体原子小,当失去全部的最外层电子而形成正离子时,就得到该体系中较小的半径。例如钠原子(2,8,1)的半径是1.86A,而钠离子Na+(2,8,0)的半径是0.95A。当形成钠离子时,不仅钠原子的最外电子层消失
了,而且剩留下来的两个电子层也缩小了,因为价电子的失去使有效核电荷增加了,这使核对每个剩余电子的平均引力变大了。在周期表的各族中从上向下,与电子层数的增多相对应,下面元素的正离子具有较大的半径(表7-3)。
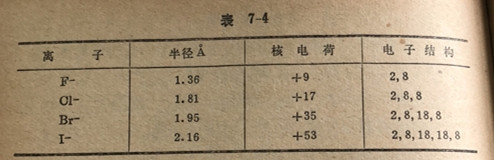
在一个原子的价电子层上增加一个或多个电子就形成一种简单负离子。这就在电子间产生较大的排斥力,减少了对每个电子的有效核电荷。两种效果都以同一方向起作用使负离子的半径大于母体原子的半径。举例来说,氯原子(2,8,7)的半径是0.99A而氯离子(2,8,8)的半径是1.81A。在族中自上向下,下面的负离子有较多的电子层和较大的核电荷,故有较大的半径(表7-4)。
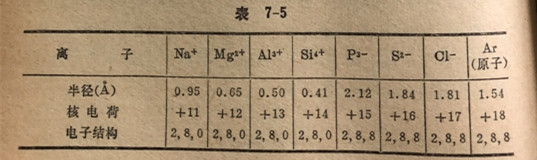
具有同样电子结构的离子,例如Na+、Mg2+、A13+系列以及P3-、S2-、C1-系列,叫做等电子体。在等电子离子系列中核电荷越大的离子半径越小,这个作用可通过表7-5的第三周期元素的离子来说明。我们在后面将会看到许多离子的性质可以最好用它们的半径大小和电荷高低来解释。