








在五氯化磷分子PCl5s中有5个P一C1键,因此在中心磷原子周围有5对价电子。为容纳5对电子,不管是孤电子对还是成键
电子对,中心原子必须有5个可用的原子轨道。磷原子最外层的8和轨道总共只有4个轨道。根据价键理论,这4个轨道同一个轨道发生杂化就可以提供多于4个可用的轨道。基态磷原子的电子结构是1s22s22p63s23p13p13p1。假定有一个38电子升级到3d轨道使结构为1s22s22p63s13p13p13p13d1,这样就提供了5个轨道可用于同5个氯原子共用电子对。这种情况叫做sp3d杂化。

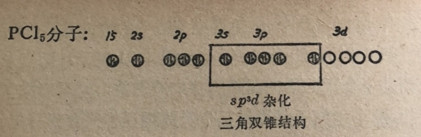
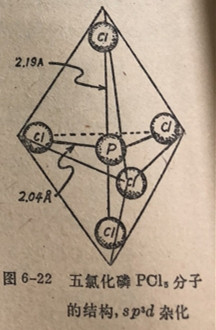
已知PCl6分子是一个三角双锥(图6-22)。其中的三个氯原子(腰部)处在个等边三角形的角顶上,而另外两个氯原子(轴上)处在三角形中心的上面和下面。有趣的是请注意在轴上的键在几何关系上同腰部的键不是等性的,并且比腰部的键要长些。在这一方面sp3d杂化轨道不同于之前讨论的杂化轨道。sp、sp2和sp3轨道杂化产生图6-22五氯化磷Pl分子在几何关系上等性的键。sp3d(或dsp3)杂化总是相当于三角双锥结构。