
根据我们对氮、氧和氟分子的研究,我们已经学习到,在O中原子间的键弱于N2中的键;在F2中的键弱于在O2中的键由于在N2、O2和F2的键能的顺序中观察到反键轨道电子数对成键轨道电子数的比值依次増大,判断出键能的级别。这三种分子的键能值支持了这种判断。
分子 键能
N2 226.000卡/摩
O2 119.000卡/摩
F2 38.000卡/摩
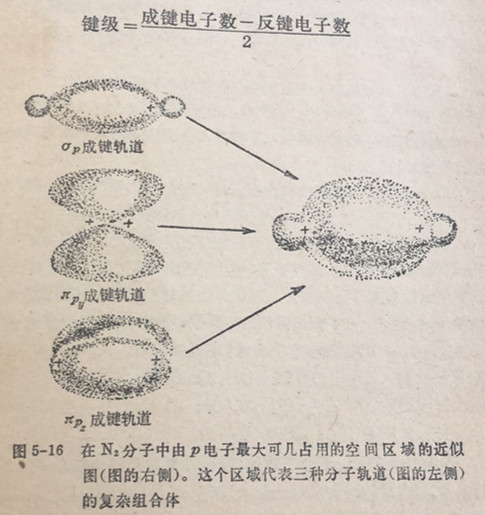
氮分子在op和πp分子轨道中有三对成键电子,我们说说它有一个参键,并说它的键级是3。在氧分子中有2个外加电子占入π*p反键轨道中(图5-12),因而减弱了这个键。6个成键电子的作用减去2个反键电子的部分抵消作用,造成一项净作用近似地相当于4个成键电子(或两对成键电子)的作用。因此,我们说氧分子有一个双键,平均起来说双键弱于参键。于是氧分子的键级是2。氟分子,在p能级中(图5-13)有6个成键电子和4个反键电子,净效果相当于两个成键电子(或对成键电子)。于是,氟分子有一个单键,键级是1。一般来说,单键既弱于双键也弱于参键。
简短的结论,一个给定键的键級等于外层的成键电子数减去外层反键轨道电子数然后除于2。