









氢分子(H2)是由两个氢原子组成的, 每一个氢原子在1s原子轨道上有一个电子。当两个氢原子的原子轨道相组合时,两个电子力图占人能量最低的分子轨道,即o,成键分子轨道。每个分子轨道可以容纳两个电子,因此,对于氢分子来说,两个电子都占据在;成键轨道中。这可以用分子轨道能级图(图5-4)表示出
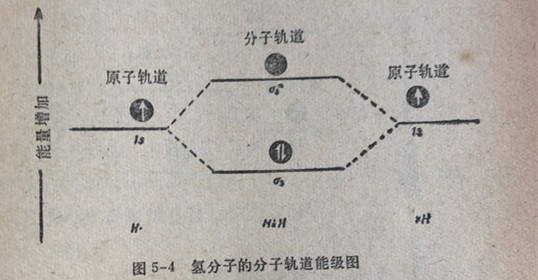
来,在轨道中的每一个电子用箭号①来表示;在一个轨道中相反自旋的两个电子用①来表示。
在氢分子中找到两个电子的最大可能区域是。轨道,它的能量比两个18原子轨道中任何一个的能量都低。因此,由两个氢原子很容易形成氢分子H2一般而言,可以说原子轨道和成键分子轨道在能量上的差异将决定于两个原子轨道重叠的程度。重叠的程度越大,能量差越大,因而形成的键越强。