











我们讨论了通过强静电引力把离子结合到一起而形成的化合物。但是还有许多化合物其中并不含有离子。这些非离子型化合物以分子的形式存在,其中含有紧密结合到一起的原子。把原子结合到一起的键叫做共用电子对键,或共
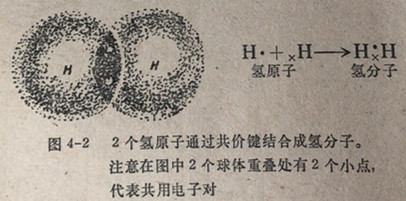
价键。原子以共价键结合的最简单的物质是氢分子H2。每个氢原子在它的1s层中有一个电子。从两个氢原子来的2个电子(一个电子对)为两个核所共用(图4-2),这2个电子同时被2个核所吸引并起着把两个核结合在一起的作用。这种键非常强,因为断开这个键需要大量的能-104千卡/摩。反过来说,当氢原子结合成1摩尔氢分子时要放出这样多的能量。
.jpg)
显然氢分子中的键不可能象离子型化合物那样是由电子转移造成的,因为两个氢原子具有相同的电离势和电子亲合势。因此,当两个原子通过共用1对电子而结合成共价分子时,这种倾向同样在起作用。当我们们把共价键的2个电子算成是为每一个氢原子所有,那么每一个原子就具有稳定的氨原子的电子排布。在氢分分子H2中每个氢原子的18轨道事实上已为共用电子对的2个电子所占用。电子对占有了整个分子,在每个原子核附近耗费的时间是相等的。图4-3具体说明了在氢分子中的电荷分布。图中深色部分代表负电荷的强度,也就是说它代表在给定区域中找到电子对的相对几率。在第5章中我们将可发现,当2个氢原子结合成一个氢分子时,电子对进人了由2个原子轨道所组成的分子轨道之中。
在氯分子Cl2中的键为共价键提供了另一个实例。每个氯原子在它的外电子层中有7个电子,这和惰性气体氬在电子构型上相比只差1个电子。在氯分子中2个原子间共用了一对电子,这就给每个原子建立了与氩原子相同的稳定电子结构。
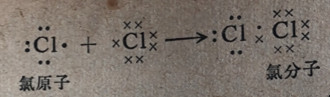
在F2、Br2、I2和和At2分子(都和Cl2处在同一族中)中的键和氯分子中的键是一样的,但形成的电子结构和其他惰气结构相同。
有许多原子为使它的价电子层达成完满的8电子结构,需要共用不止一对电子。举例来说,氮分子N2中的原子共用了3对
电子。这样可以使每个氮原子的价电子层中总共有了8个电子。

我们说在N2分子中的两个原子是被一个三键结合到一起的。