











与原子间形成化学键有关的电子是电中性原子的最外层电子(有时包括次外层电子),这些电子叫做价电子。元素的原子如果在最外层只有一个或二个电子(活泼金属),当它们同别的元素的原子化合时,往往要失去电子。一个原子失去一个或多个电子便带有正电荷,失去电子的原子叫做正离子。当钠原子和一种元素如氯的原子发生化学结合时,钠原子失去了它的一个价电子而取得了+1电荷。镁原子总是失去它的2个价电子而取得了+2电荷。
NA(钠原子)->Na+(钠离子)+e-
MG(镁原子)→MG2(镁离子)+2e-
原子中的价电子越少,在它同其他元素的原子发生化学结合的过程中,这种元素失去电子的倾向越大。从一种电中性原子拿走一个电子生成一个正离子所需要的能量叫做该原子的电离勢。这个能量常表示为电子伏特。一些金属具有小的电离势并容易形成正离子。非金属元素在它们的外电子层里有比金属元素较多的电子,它们具有大的电离势,并且生成正离子的倾向是很小的。
那些在最外电子层中电子数比8个电子少1或2个电子的原子倾向于从某些其他原子例如钠或镁原子取得足修的电子,使最
外电子层达成完满的8电子结构。电中性原子获得电子时变成为负离子。非金属如F、C1、Br、I、0和S是容易形成负离子的。
C1(氯原子)+E-→C1-(氯离子)
S(硫原子)+2E-→S2-(硫离子)
一个电中性原子对电子的吸引叫做它的电子亲合势。非金属元素具有高的电子亲合势而金属元素则具有低的电子亲合势。因此,非金属元素在同金属元素化合时便倾向于形成负离子。
当一个正离子和一个负离子互相靠近时,在符号相反的电荷之间便建立起强大的静电引力,我们便说这两种离子通过离子键而结合起来了。有时用电价这个术语来标志这种类型的化学结合。
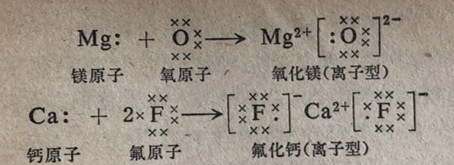
在化学结合过程中发生的电子结构变化可以筒单地用一套记载系统来表示,在其中用元素符号代表除了价电子之外的原子整体;在符号的周围写上价电子。这种记载符号叫做价电子符号。可以用价电子符号来表示化合物的化学式。这种化学式叫做价电子式,或路易斯( Lewis)化学式。价电子用(・)、(×)和(○)等符号来代表。用不同的符号来代表电子是借以区别它们的不同来源;但必须记住,所有的电子不管它们的来源如何都是等同的。
用价电子符号和路易斯化学式来表示通过电子转移而形成些离子型化合物的过程举例说明如下。
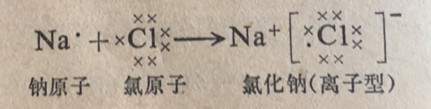
一种元素的原子和离子具有完全不同的物理和化学性质。金属钠是一种软的银白色金属,它在空气中猛烈地燃烧和快速地同水反应。单质氯是一种黄绿色气体,它对多数金属有极强的腐蚀性,并且对动植物有极强的毒性。钠原子和氯原子可以发生猛烈反应生成氯化钠(食盐)。这个化合物中含有钠离子和氯离子,它的存在为晶状固体,它的性质与作为单质的钠和氯的性质是完全不同的。氯是有毒的,但氯化钠却是生命所必需的。
一颗氯化钠晶体是由有规则的几何排布的钠离子和氯离子组电成的(图4-1)。每个钠离子被6个氯离子所包围,而每个氯离自子又被相相邻部的6个钠离子所包围。在晶体中把离子结合到一起的
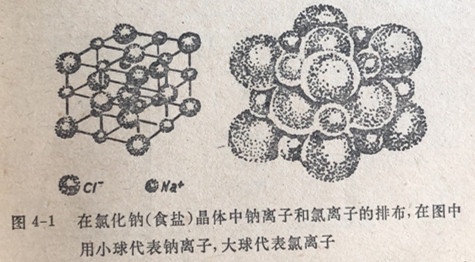
力是带相反电荷的离子之间的静电引『力。在晶体中任何一个给定的离子对它所有的6个带相反电荷的近邻离子所施加的力都是一样的,因此无法区別哪一个钠离子和哪一个氯离子在组成一个氯化钠分子。于是,在真正的离子型化合物中并没有分子,一粒离子型化合物的晶体乃是离子的聚集体。离子型化合物的化学式代表能使离子电荷代数值相等时所需要的离子的相对数目。由于一粒氯化钠晶体是电性中和的,它必须含有相同数目的Na+和C1厂离子子,因此它的化学式是NaCl。一粒氧化钠晶体所含的Na+离子是O2-离子的2倍,它的化学式是Na2O。于是,对离子型化合物来说,“分子量”是没有意义的。化学式NaCl代表氯化钠的化学式量;但不能说它代表分子量,因为并没有氯化钠分子。国际单位制(SI)建议用术语摩尔质量来代替所有化合物的“分子量”和“化学式量”。
离子型化合物往往是硬的晶状固体,它们具有高的熔点和低的挥发性。它们在熔化时或溶解在适宜的溶剂中能够传导电流,在这些情况下离子变得能自由流动了。
