










![水杨酸甲酯[冬青油]](images/201812/thumb_img/964_thumb_G_1545823931913.jpg)
水和空气一样,也是人们不可缺少的一种物质,自然界里存在的水叫做天然水,例如海水、河水、井水、雨水等,天水一般都是不纯净的,它或多或少溶解有某些可溶性的杂质,有时还悬浮有固体的杂质如污泥、砂粒、动植物的残渣以及某些病原菌等。

在小学自然课里我们已经学过一些有关水的知识,这里着重研究水的性质。
水的物理性质纯净的水(实验室里用的蒸馏水是比较纯净的)是无色、无味、无嗅的透明液体.在1大气压下,水在100C时沸胯,0C时凝固成冰.在4C时水的比重是1,即此时1毫升的水重1克,在高于或低于4C时,它的比重都比1小.冬天河水表面遇冷结冰,因为冰的比重比水小,能浮在水面上,下层河水由于和冷空气相隔绝,不易冻结到底,这对保
存鱼类的生命具有重大意义.水是一切固体和液体物质中比热①最大的一种物质.水的这种性质,对调节气温温,起着巨大的作用.例如在沿海一带,白天虽然受到太阳的照射,但因水的比热特别大海水温度升高时要吸收大量的热,因此气温不会升得太高到了晚上,海水温度降低,又放出大量的热使气温不致降得太低。
水有很好的溶解性,大多数物质都能或多或少地溶解在水里.动植物一般都只能吸取溶解在水里的养料,因此,它是动植物生长不可缺少的一种物质。
①比热就是1克物质温度升高(成降低)1℃所吸收(成放出)的热量的卡数(卡是热量的单位),水的比热是1,即1克水温度升高(或降低)1℃需要吸收(放出)1卡的热量。
水的化学性质
1,水的分解水是由氢、氧两种元素组成的一种性质比较稳定的化合物,在水分子里,氢原子和氧原子的结合十分牢固.即使把水加热到1000℃以上的高温,也只能有极少量的发生分解,但是,它在电流作用下,却比较容易分解,并在两个电极上分别放出氢气和氧气,这在§1·5里已经初步介绍过了。
利用图2·18的装置,可以收集水分解后放出的氢气和氧气。
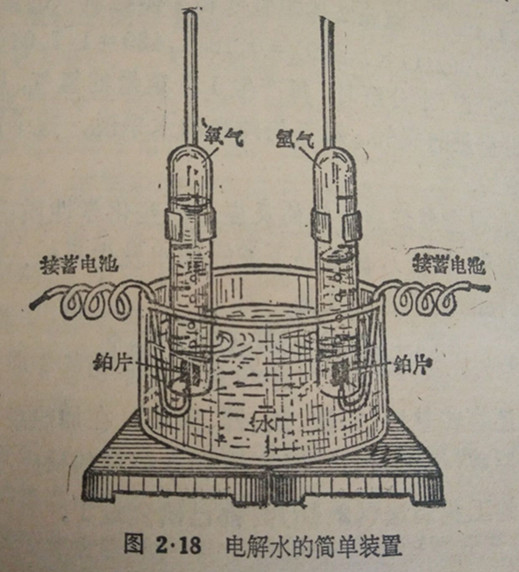
在玻璃缸内盛水①约2/3.另用铁架合固定住两个有刻度的试管,试管里盛满着水,倒立在玻璃缸里.在试管口处各有铂片一小块(作为电极),用导线把铂片和蓄电池的两极相连.当导线接通后,不久就可看到铂片上有气泡不断产生,试管里的水随著排出.,经过一完时间后,可以看到一只试管里的气体体积正好是另一只试管里的两倍。
①为了增加水的导电能力,可以在水里加入少量硫酸。
用手指按住试管管口,从玻璃缸内取出,倒转,把带有余烬的木条移近气体体积较少的那只试管口时,木条重又燃烧起来,这说明试管里的气体是氧气,把燃着的木条移近气体体积较多的那只试管口时,气体就燃烧起来,这说明试管里的气体是氢气。
这个实验的结果指出:水分解时,产生的氢气和氧气的体积比是2:1。
根据气体的比重,可以把体积换算成重量量,这样就可以算出氢气和氧气的重量比.已知氢气每升约重0.090克,氧气每升重1.429克·因此2体积氢气和1体积氧气的重量比是:
(2×0.09):(1×1.429)=0.18:1,429=1:7.94(约1:8)
这就是说,水分解时,每产生1分重量的氢气,同时必定产生8分重量的氧气,对任何纯净的水来说,这个比值总是固定不变的。
2.水和金属或非金属的反应某些化学性质比较活泼的金属(如钠、钙等),在常温下就能和水发生反应,例如钠和水发生反应的化学方程式是:
2Na+2H2O=2NaOH+H2个
钠 水 氢氧化钠 氢气
另外还有些单质(如铁、镁、锌、碳等),在加热条件下也能和水发生反应例如炽热的铁、炭和水蒸气的反应,这在前面讲到氢气的工业制法(210)时都已研究过了。