












前面讲到的实验室里用稀硫酸和锌作用制取氢气的化学方程式是:
Zn+H2SO4=H2个+Znso4
从这个化学方程式可以看出,这个反应既不同于分解反应(S1·5),也不同于化合反应(S2·3).在这个反应里,一种单质(锌)和一种化合物(硫酸)相互作用,生成一种新的单质(氢气)和新的化合物(硫酸锌),象这种类型的化学反应,称做置换反应.

根据原子-分子论观点,锌和硫酸置换反应的实质是:单质锌的原子代替了硫酸分子里氢原子(共2个)的位置,变成硫酸锌分子;而硫酸分子里的氢原子被替换出来后,每2个氢原子结合成为1个氢气分子,如下图(图2·15)所示:
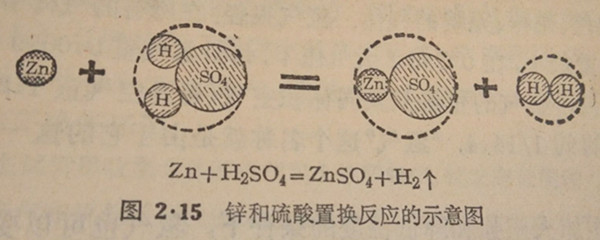
Zn+H2SO4=ZnSO4+H2个
工业上用水蒸气和炽热的铁屑或煤炭制取氢气的化学反应:
3Fe+4H2O=高温=Fe3O4+4H2个
C+H20=高温=C0个+H2个
也是属于置换反应的类型.
置换反应细解:
置换反应的定义
所谓的置换反应实际上就是单质和化合物产生反应,然后生产了另外一种单质与化合物的一种化学反应,而化学置换反应是高中化学四种基础反应种类之一,其包含了金属和金属盐的反应、金属和酸的反应等等。
置换反应是单质和化合物的作用,从而生成另种单质和化合物的反应。置换反应通常可以使用这一式子来表述:A+BC=B+AC或者是AB+C=AC+B。
一般置换反应实际上大部分是氧化还原反应,可是部分比较特殊的化学反应,比方说金属羰基化合物之间的置换,这就不是所谓的氧化还原反应了。另外,也可说路易斯酸之间的置换反应,这个时候不需要单质参加反应。可以把另外一个比较弱的路易斯酸从稳定的配离子之中置换出去。
置换反应类型
1、对于金属置换成金属的分析
首先在金属活动之中,处在氢化学元素之前的金属,例如Mg、AI、Zn、Fe等等均可以将氢化学元素之后的金属,比如Cu、Ag、Hg等等由其化合物溶液里面置换出去。打个比方:Fe+CuSO4=Cu+FeSO4、Zn+CuSO4=Cu+ZnSO4、Cu+2AgNO3=Cu(NO3)2+2Ag。
其次在金属活动程序里面,处在氢化学元素之后的金属可以将不活泼的金属从其化合物溶液里面置换出去,打个比方:Cu+2AgNO3=2Ag+Cu(NO3)2。
最后金属活动程序里面处在氢化学元素之前的金属不可以在溶液里面起到置换反应,只可以在没有水的情况下进行化学置换反应。比如说:2Al+Fe2O3→2Fe+Al2O3、4Al+3MnO2→3Mn+2Al2O3。
2、对于非金属置换金属反应的分析
部分非金属氧化性比不上一部分高价金属化合物的氧化性,所以,部分非金属将部分高价的金属化合物金属置换出去。打个比方:C+2CuO→2Cu+CO2↑、H2+CuO→Cu+H2O、Si+2FeO→2Fe+SiO2、C+2Fe2O3→4Fe+3CO2↑。
在非金属置换金属中,工业冶炼铁中的置换反应,比如:2Fe2O3+3C=2Fe+3CO↑,在加热的情况下,氢气可还原成氧化铜或者氧化铁等等。比如:Fe2O3+3H2=2Fe+3H2O、CuO+H2=Cu+H2O。
3、对于金属置换为非金属的反应分析
一、活泼金属比如Na、Ca、K等等在室内温度的情况下和水产生剧烈的反应,从而置换出氢元素。打个比方:2K+2H2O=2KOH+H2↑。
二、一些金属如:Mg、Al、Fe、Zn比Na、K不活泼金属和水在加热以及温度比较高的情况下反应置换氢气,比如:3Fe+4H2O→Fe3O4+4H2。
三、在金属活动程序里面氢元素前面的活泼金属,比如说Mg、Fe、Zn、Al在室内温度下可以从不是氧化性的酸,例如稀硫酸、盐酸之中置换氢元素。打个比方:Zn+H2SO4=ZnSO4+H2↑。
四、比较活泼的金属,例如Na、K等等均可以将有机物羰基与其中的氢元素置换出去,比如说:2C6H5OH+2Na→2C6H5ONa+H2↑。
五、Zn可以从强碱里面置换氢元素,比如NaOH溶液。化学式子是:Zn+2NaOH=Na2ZnO2+H2↑。
六、活泼金属可以将非金属从其氧化物里面置换出去,好比:2Mg+CO2→2MgO+C。
4、对于非金属置换出非金属反应分析
活泼非金属可以将其不活泼非金属从其化合物里面置换出去,例如:
一、卤素置换卤素反应:Cl2+2KBr=2KCl+Br2。
二、非卤素置换非卤素:C+H2O(气)→CO+H2。
三、卤素置换非卤素反应生成:3Cl2+2NH3=6HCl+N2、Cl2+H2S=2HCl+S。
四、氨气与氯气不可以一同存在,相遇的时候会出现置换反应,比如:8NH3+3CI2=6NH4CI+N。
五、在温度比较高的情况下,使用碳还原二氧化硅来制取粗硅,接着得到纯硅,比如SiO+2C=2CO+Si。
置换反应规律
置换反应是化学反应的四大基本反应类型之一,可用A+BC=AC+B的形式表示,其中A、B是单质,BC、AC为化合物。下面就初中化学涉及的内容,分类谈谈置换反应的一般规律以及注意事项。
一、在水溶液中进行的置换反应
1、金属与酸溶液的置换反应
这类反应与金属的化学活动性有关,可利用金属的活动性顺序表进行判断,常见金属的活动顺序为:
.png)
只有排在氢以前的金属才能置换出酸中的氢。应用上述规律写化学方程式时还需注意以下几点:
①金属:一般是指在活动顺序表中H前Mg后的金属。
②酸:一般是指非氧化性酸,如稀盐酸、稀硫酸。
③铁在与酸发生置换反应时,只能生成二价铁盐。
例如,下列化学方程式均是错误的:
Cu+2HCl=CuCl2+H2↑
Zn+2HNO3=Zn(NO3)2+H2↑
2Fe+6HCl=2FeCl3+3H2↑
2、金属与盐溶液的置换反应
这类反应的一般规律是:在金属活动顺序表里,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液中置换出来。例如:
Cu+Hg(NO3)2=Cu(NO3)2+Hg
Zn+CuSO4=ZnSO4+Cu
应用上述规律书写化学方程式时也应注意三点:
①在金属活动性顺序表中,钾、钙、钠不能置换出其它金属,如化学方程式2Na+CuSO4=Na2SO4+Cu是错误的。
②盐必须是可溶性的,不能只记住前面金属能置换后面的金属。如化学方程式Cu+2AgCl=CuCl2+2Ag是错误的。
③铁在与盐反应时,只能生成二价铁盐。如化学方程式2Fe+3CuSO4=Fe2(SO4)3+3Cu是错误的。
二、加热或高温条件下的置换反应
1、氢气还原金属氧化物,生成相应的金属和水。例如:
CuO+H2→Cu+H2O
Fe2O3+3H2→2Fe+3H2O
2、碳在加热或高温条件下,跟某些金属氧化物反应,生成金属和CO2。例如:
2CuO+C→2Cu+CO2↑
2Fe2O3+3C→4Fe+3CO2↑
3、其它还原性单质与某些金属氧化物在高温下发生置换反
应。例如,在冶炼铁时,发生如下反应:
Si+2FeO→2Fe+SiO2
金属铝与某些金属氧化物在高温时发生如下反应:
2Al+Fe2O3→Al2O3+2Fe
2Mg+CO2→2MgO+C
相关文章
金属的化学置换反应https://www.999gou.cn/article.php?id=1518
补充资料:置换反应化学方程式:置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。它是一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应。置换反应可表示为A BC=B AC 或 AB C=AC B,通常认为置换反应都是氧化还原反应,但是一些特殊的反应,例如金属羰基化合物间的置换,则不是氧化还原反应。
置换反应方程式
一、金属单质 酸--------盐 氢气(置换反应)
1、锌和稀硫酸反应:Zn H2SO4===ZnSO4 H2↑
2、镁和稀硫酸反应:Mg H2SO4===MgSO4 H2↑
3、铝和稀硫酸反应:2Al 3H2SO4===Al2(SO4)3 3H2↑
4、锌和稀盐酸反应:Zn 2HCl===ZnCl2 H2↑
5、镁和稀盐酸反应:Mg 2HCl===MgCl2 H2↑
6、铝和稀盐酸反应:2Al 6HCl===2AlCl3 3H2↑
1-6的现象:有气泡产生。
7、铁和稀盐酸反应:Fe 2HCl===FeCl2 H2↑
现象:有气泡产生,溶液由无色变成浅绿色。
8、铁和稀硫酸反应:Fe H2SO4===FeSO4 H2↑
铁参加的置换反应显 2价,现象:有气泡产生,溶液由无色变成浅绿色。
二、金属单质 盐(溶液)---另一种金属 另一种盐
1、铁与硫酸铜反应:Fe CuSO4==Cu FeSO4
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
(古代湿法制铜及“曾青得铁则化铜”指的是此反应)
2、锌片放入硫酸铜溶液中:CuSO4 Zn==ZnSO4 Cu
现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
3、铜片放入硝酸银溶液中:2AgNO3 Cu==Cu(NO3)2 2Ag
现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。
三、金属氧化物+木炭或氢气→金属+二氧化碳或水
1、焦炭还原氧化铁:3C 2Fe2O34Fe 3CO2↑冶炼金属
2、木炭还原氧化铜:C 2CuO2Cu CO2↑冶炼金属
现象:黑色粉未变成红色,澄清石灰水变浑浊。
3、氢气还原氧化铜:H2 CuOCu H2O
现象:黑色粉末变成红色,试管内壁有水珠生成
4、氢气与氧化铁反应:Fe2O3 3H22Fe 3H2O
5、水蒸气通过灼热碳层:H2O CH2 CO水煤气的制法