根据周期律,把现在已知的105种元素,按照它们原子序数(核电荷数)递增顺序依次排成一个长列,然后把这个长列分成若干部分,每一部分都是从最活动的金属元素开始到惰性气体为止.并把这些部分各称为一个周期.然后再把各周期上下相迭,使不同周期内性质相似的各元素处于同一纵行就象上节中中我们对从锂到氩所做的那样.制成了元素周期表①,所以周期表实际上就是周期律的具体表现形式.
元素周期表里所显示出来的各种元素性质递变的规律,对指导学习化学有很大帮助,因此我们首先要熟悉一下这个
表的结构。
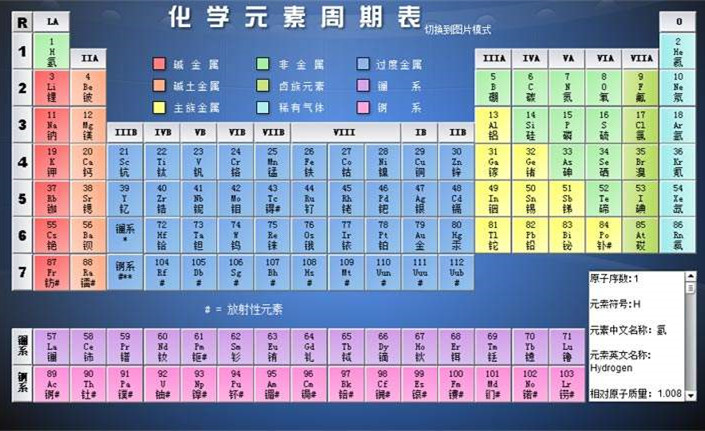
周期 元素周期表里在横的方面共分7个部分,每个部。分是一个周期,所以一共有7个周期.所谓周期,就是按照原子序数递增版序排列,从一种最活动的金属开始(第一周期除外),到惰性气体为止的一系列元素.这些元素具有相同的电子层数.
①这个表的形式和所表示的元素性质递变规律,和1871年门捷列夫按当时已知的63种元素按原子量递增顺序所排列出来的,并没有多少变动,只是增加了后来发现的一些元素。
在周期表里,我们可以看到,每个周期里元素的数目并不相同.第一周期里只有氢和氮2个元素,第二和第三周周期里各有8个元素,这三个周期称为短周期.第四和第五周期各有18个元素,第六周期有32个元素,第七周期到现在为止还只发现了19个元素.这四个周期都比较长,所以叫做长周期.其中第七周期还未成一个完整的周期,因此又叫做不完全周期、
在短周期里,元素最外电子层里的电子数依次从1个递增到8个(第一周期从1个到2个),比较简单.在长周周期里,最外电子层里的电子数,虽然也是逐步从1个递增到8个,但元素的核外电子排布情况,就比较复杂,我们以第四周期为例来说明长周期里元素的电子排布,以及由此而引起的化合价变化的情况。
第四周期开始的两个元素钾和钙,电子增加在最外层里,从第3个元素钪到第11个元素铜共9个元素,它们的电子般都增加在次外层里(个别例外),而从第12个元素锌开始,电子重新又增加到最外电子层里,直到惰性气体氪最外电子层达到8个电子.因此,这个周期里开始的两个元素(钾和钙)和最后的6个元素(镓起到氪止),它们最外电子层里电子数的变化和短周期的元素相似,也就是在最外电子层里,电子依次由1个递增到8个.这样比较复杂的电子排布,反映在各元素的化合价变化上的情况是:从钾到锰的最高正化合价是1价增加到+7价,和短周期里各元素的正化合价的变化相同.但是,在短周期里,+7价元素的后面接着是一个零价元素(惰性气体),而在这个长周期里,锰以后是三个性质相似的元素:铁、钴、镍.这三个元素和短周期里的任何元素都不相似.后后面的铜,化合价又骤然降到+1价,以后从铜的+1价开始,又依次增加到溴达到+7价.溴溴以后是惰性气体氪,它
是这个周期的最后一个元素。
第六周期里,从原子序数是57的元素镧(La)起,到原子序数是71的元素镥(Lu)为止,共15个金属元素,它们组成系元素.由于它们的性质相似,在周期表里只能占一格位置,这样,表内格子中写不下这许多元素,所以把镧以后的14个元素排在表外。
第七周期里,原子序数89的元素钢(Ac)以后的14个元素彼此性质极为相似似,称为钢系元素.我们也把以后的元素排在表外.
族 元素周期表从纵的方面看,共有18个纵行,除了第八、第九、第十这三个纵行算作一族叫第Ⅷ族外,其他十五个纵行,每一个纵行叫做一族.族分两种,一种叫主族,一种叫副族.通常把由短周期的元素和长周期的元素共同构成的族,叫做主族;完全由长周期元素构成的族,叫做副族.周期表靠左边的两个族和靠右边的五个族是主族,分别用IA、IA、A、“表示.主族元素的最高价氧化物中元素的化合价等于该元素原子最外电子层上的电子数自第Ⅳ主族起起,元素的负化合价等于8减去该元素所属的族数。
最右边一族是惰性元素,它们在通常情况下不起化学变化,化合价是零,因此称为零族,周期表中间的部分是副族元素.自左至右分别以B、IVB……IB、B表示。
在元素周期表里,每种元素一般都占一格.在每一格里,均标有元素符号、元素名称、原子序数和原子量。
元素周期表的终结
一般我们可能直观地认为,填满元素周期表的应该是第118 号元素,但118 号元素OG 其实早在2006 年就被人工合成。而117 号元素的合成还要晚四年,是在2010 年由美国劳伦斯利弗莫尔国家实验室,橡树岭国家实验室,和俄罗斯杜布纳联合核研究所的科学家们同时完成的门捷列夫的周期表,为许多当时未知的元素预留了位置。
他告诉世人,元素周期表不仅仅是所有元素由轻到重的简单罗列,我们还能依据它来预测各元素的物理性质与化学性质,门捷列夫之所以会产生如此天才的想法,是因为虽然当时发现的元素还不多,只有63 种。
但将它们按原子质量进行增序排列后,他注意到这些元素的某些属性在排列中,呈现出了周期性的特点,那就是随着原子序数的增大,各种元素的颜色、外观与化学反应等属性,都体现出了周期性变化。比如原子质量为19 的氟,它可以与金属发生剧烈的反应,而位于同一序列的原子质量为35 的氯,以及原子质量为80 的溴,也呈现出了类似的特点,同样的原子质量40 的钙,与原子质量137 的钡都能在高温下保持固态,等等这些。
.jpg)
门捷列夫他将其称之为“周期性原理”,并在此基础上,将有着相似化学性质的元素列在了同一列,同时留下了大片的空白,1875 年门捷列夫的预言首次获得证实。法国化学家布瓦博德朗发现了镓,填补了周期表中的第一个空格,之后在1879 年,人们发现了钪,1886 年又发现了锗,这些元素的发现,无一例外地证实了门捷列夫的预言。不过对于当时的人们来说元素为什么会呈现出这样一种周期性规律,人们是并不清楚的,这个问题的解决,要得益于量子力学的出现。20 世纪初随着量子力学的不断发展,终于在1925 年,人们得出了关于元素周期表的解释,那就是元素性质的周期性,是原子核外各层电子的排布状况所决定的。也就是说某个元素的化学性质,并不取决于它的原子质量,而是取决于原子最外层的电子数,而周期表上位于同一列的元素,也都有着相同的最外层电子数,按照这一规律,人们便得到了一张118 格的元素周期表。
那么为什么是118 呢,为什么不是881 呢?为什么不是八万呢?其实理论上可以存在无穷多的元素,但所有的计算结果都表明,拥有超过特定数目质子的原子核是无法形成的,因为它们都太不稳定,仅能存在极短的时间。当然了118 只是一种情况,不同的模型得出的临界质子数也不相同,有些模型中,可以存在的元素的最大序数是172 或是173,还有一些模型的结果是137,不过不管多少,人们的结论是相同的,那就是虽然理论上存在无穷多的元素,但当质子数大到一定程度的时候,元素存在的时间极其短暂,即使在宇宙某些极端的环境中可以生成,但存在的时间也几乎可以忽略不计。
其实虽然我们说现在元素周期表已经被填满了,但核物理学家一直没有放弃寻找更大元素的努力,比如119 号和120 号元素。由于元素中一些幻数的存在,一些超重元素可能具有较高的稳定性,存在的时间可能达到几分钟甚至几年,当然了这只是猜想。
就在量子力学给出元素周期表确证的同一年,最后一个天然元素,75 号元素类锰,也就是铼,被德国化学家诺达克于锰铁矿中发现,之后人类便走上了人工合成元素的漫漫长路,1940 年科学家,成功合成了第一个人造元素93 号元素镎,之后钚、镅等超铀元素也都相继被合成。
元素周期表上就差一个位置虚位以待了,那么这个117 号元素为什么这么难呢,我们简单看一下合成的过程,就知道这是怎样的巨大难题,首先科学家对一份镅元素样本,在美国橡树岭国家实验室进行了18 个月的辐射。随后这份具有高度放射性的锫被带回德国美因茨,制成靶体后,又被送到了德国赫尔姆霍茨重离子研究中心在那里的加速器中接受钙离子束的轰击,在几个月的狂轰滥炸后,科学家对样本进行检验,在其中终于找到了117 号元素的痕迹,可见就这样一点微不足道的收获,正是实验技术突破极限的成就。
而同一时期,俄罗斯杜布纳联合原子核研究所,也成功完成了类似实验,就这样元素周期表被填满了。看着满满当当的元素周期表,估计很多物理学家和核物理学家的心情是满足的,以门捷列夫开端,到117 号元素的成功制造,人类终于完成了这场140 多年的接力赛,这期间多少人将毕生的心血都倾注其中。也有太多人甚至为此付出了宝贵的生命,同时随着越来越重的元素被逐一发现,门捷列夫的天才设想,也一次次地被证实,但是瑕疵还是存在的,那就是一些重元素与周期性原理的预测并不完全吻合,周期性原理的可靠性遭到了挑战,特别是对于一些超重元素来说,周期性原理甚至完全不适用,完全失去了意义。
最后得到的元素性质与周期性的预测完全不一样,其实不只是这些人造的重元素与超重元素,一些较轻的天然元素也呈现了反常的状态,比如第一副族中的金是黄色的,上面的银却是灰白色的,还比如汞,这哥们在常温下呈现为液态,而其他所有金属元素常温下都是固态的,还有84 号元素钋的晶体结构是立方体,而位于它上方的52 号元素碲,则有着六边形的晶体结构,那么我们该如何解释这些反常现象呢?这就要用到相对论了,随着原子序数的增加,原子核中质子数上升,核电荷增强,这使得离原子核较近的电子获得了更高的运动速度,按照这个趋势,当原子核中质子达到100 左右时,电子的运动速度将变得极大,以致产生显著的相对论效应,由于质能转换,如此一来元素的质量也随之增大,又反过来影响到原子内电子的排布以及它们的运动轨迹,比如说在上世界90 年代科学家就发现,104 号元素钅卢,在溶液状态下竟然能像钚一样反应,要知道这哥俩在周期表中可是相隔了10 个纵列,另外105 号元素钅杜,甚至与相隔14 列的91 号元素镤,有着相似的化学性质,还有虽然106 号元素钅喜的化学性质,与周期表的预测相吻合,但它的性质却与同族中的相邻元素钼和钨,有着较大的差异,像上面这些例子还有很多,我们就不一一列举了。
可见元素周期表到了后面部分,我们就无法根据周期性原理,仅仅通过同族元素的化学性质来推测其他元素的属性,不过我们还要了解的是,超重原子核领域的研究其实还处于刚刚起步的状态,还有很多未解之谜需要去破解,就比如114 号元素鈇,它就要比理论预言拥有更显著的相对论效应。
但毋庸置疑的是,对于超重元素来说,我们已经无法从它们在元素周期表中的位置,来准确预测其化学性质了。所以说到现在为止,元素周期表已经失去了预测功能,它被填满了,当然了填满了并不等于被掏空了,就像牛顿万有引力定律一样,任何事物都有其历史属性,存在于一定的历史范畴之中,甚至是地心说这样的,我们现在看来荒诞不经的理论,也在历史上发挥了巨大的作用。这些贡献我们都不能抹杀,至于元素周期表失效的事实,也早在所有人的预料之中,这就是科学的发展,也是人类的进步,况且元素周期表还并没有被取代,它根据核外电子排布状况对元素化学性质进行分类的方式,对我们仍然有着巨大的意义,仍然是最基本的化学元素分类法。门捷列夫的宏伟构想走到了尽头,但化学的发展却依然消无声息地日新月异。
化学元素周期表更多介绍
化学元素周期表知识https://www.999gou.cn/article.php?id=257
元素周期律的性质与变化https://www.999gou.cn/article.php?id=256
化学同周期元素性质的递变规律https://www.999gou.cn/article.php?id=258