锰(Ⅵ)的化合物中,比较稳定的是锰酸盐,如锰酸钠和锰酸钾。锰酸盐是制备高锰酸盐的中间产品。
锰酸盐只有在强碱性溶液中(pH>14.4)オ是稳定的。如果在酸性甚至近中性的条件下,MnO42-易按下式发生歧化。
3MnO42-+4H+=2MnO4-+MnO2+2H2O
对于有多种氧化态的元素,它的哪种氧化态容易发生歧化反应,除可用元素电势图可判断外,还可以通过自由能-氧化态图加以判断。如果中间氧化态是处于连接较低和较高氧化态的一条假想直线的下面(见图21-8中虚线),那么中间氧化态是相对稳定的。反之,如果中间氧化态是在该直线的上面,则该中间氧化态是相对不稳定的。例如,Mn(Ⅵ)的位置高于从Mn(Ⅶ)到Mn(Ⅳ)的连接线,这说明MnO42-可以歧化成MnO4-和MnO2。而MnO2正好低于MnO42-和Mn3+的连接线,表明它不能歧化为MnO42-和Mn3+。可是Mn3+却可以歧化成MnO2和Mn2+,这些情况与实验现象都是相符的。

锰(Ⅶ)的化合物中最重要的是高锰酸钾。锰酸钾溶液中加酸,虽可制得高锰酸钾,但最高产率只有66.7%,因为有1/3的锰(Ⅵ)被还原成MnO2。所以最好的制备方法是用电解法或用氯气、次氯酸盐等为氧化剂,把全部的MnO42-氧化为MnO4-。
2MnO42-+2H2O=(电解)2MnO4-+2OH-+H2↑
2MnO42-+Cl2=2MnO4-+2Cl-
高锰酸钾是深紫色的晶体,它是一个较稳定的化合物。其水溶液呈紫红色。

将固体的KMnO4加热到473K以上,就分解放出氧气,是实验室制备氧气的一个简便方法。
2KMNO4=K2MnO4+MnO2+O2↑
高锰酸钾的溶液并不十分稳定,在酸性溶液中缓慢地、但明显地进行分解:
4MnO4-+4H+=4MnO2+3O2+2H2O
在中性或微碱性溶液中,这种分解的速度更慢。但是光对高锰酸盐的分解起催化作用,因此,KMnO4溶液必须保存于棕色瓶中。
KMnO4是最重要和常用的氧化剂之一。它的还原产物因介质的酸碱性不同而有所不同。
在酸性溶液中,MnO4-是很强的氧化剂。例如,它可以氧化Fe2+、I-、Cl-等离子,还原产物为Mn2+。
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
分析化学中,用KMnO4的酸性溶液测定铁的含量,就是利用此反应。如果MnO4-过量,它可能和Mn2+发生氧化还原反应而析出MnO2。
2MnO4-+3Mn2++2H2O=5MnO2+4H+
MnO4-与还原剂的反应,起初较慢,但Mn2+的存在,可以催化该反应。因此,随着Mn2+离子的生成,反应速度迅速加快。
在微酸性、中性、微碱性溶液中,MnO4-与还原剂反应时,被还原成MnO2。例如,在中性或弱碱性介质中,KMnO4与K2SO3的反应。
2KMnO4+3K2SO3+H2O=2MnO2↓+3K2SO4+2KOH
在强碱性溶液中,则被还原为锰酸盐。
2KMnO4+K2SO3+2KOH=2K2MnO4+K2SO4+H2O
高锰酸钾广泛用于容量分析中,测定一些过渡金属离子,如Ti3+、VO2+、Fe2+以及过氧化氢、草酸盐、甲酸盐和亚硝酸盐等。它的稀溶液(0.1%)可以用于浸洗水果、碗、杯等用具的消毒和杀菌,5%的KMnO4溶液可治疗轻度烫伤。
粉末状的KMnO4与90%H2SO4反应,生成绿色油状的高锰酸酐Mn2O7。它在273K以下稳定,在常温下会爆炸分解成MnO2、O2和O3。这个氧化物有强氧化性,遇有机物就发生燃烧。将Mn2O7溶于水就生成高锰酸HMnO4。
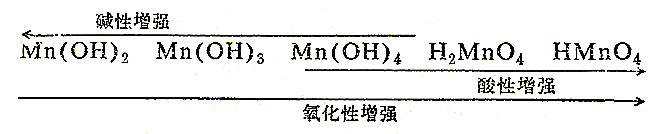
以上我们着重讨论了锰的不同氧化态化合物的氧化还原性。锰之所以存在上述各种情况,这首先决定于它有着七个可以成键的价电子。但是,究竟有多少电子成键,使某氧化态转化为另一氧化态,这和溶液的酸碱性以及与它反应的氧化剂或还原剂的相对强弱等条件有关。因此,在学习过程中应加以重视。现将锰的各种氧化态的氧化物和氧化物的水合物归纳如下:
锰能生成以下各种氧化物:
MnO Mn2O3 MnO2 (MnO3) Mn2O7
氧化锰 三氧化二锰 二氧化锰 锰酸酐 高锰酸酐
碱性 弱碱性 两性 酸性 酸性
和上述氧化物相对应的氧化物水合物: