催化作用最基本的共同点在于少量催化剂的存在可以导致反应速率有很大变化(加速),虽然催化剂在反应终了时其化学组成不变,但催化剂对于反应并非单纯惰性背景的提供者,而是反应的积极参加者。因此通过反应后,催化剂的物理形态可以有所不同,对复相催化尤为明显,例如:许多固体催化剂反应后其晶体颗粒大小与晶形等均可以有所改变。
由于催化剂只能加速热力学所允许的反应实现,而不能“引起”热力学所不允许的反应实现,因此反应达到平衡后,再加入催化剂,反应不复进行。此特点的前提条件是催化剂本身没有变化或很少变化。对于液相的催化反应有时由于催化剂与产物之间强烈的物理作用,表观上可以“改变”平衡。例如:以硫酸作为催化剂使有机物(如醇类)脱水的反应,由于催化剂被产物中之水所稀释(其化学形态并未变化)而使平衡“移动”。显然这种现象并不违背热力学的规律。
应该指出,上述特征并不意味着,凡是催化剂存在时可以进行的反应,当催化剂不存在时反应必须仍可进行(即便是十分缓慢)。也就是说:并不意味着:凡是热力学允许的反应,在不具备动力学的条件下反应亦能缓慢进行。例如:活化能约为80kcal·mol-1(约335kJ·mol-1)的气相单分子反应。室温下每毫升中的活化分子的数目(注意:不是活化分子分数,也不是活化分子的克分子数)约为:
2.7×1019×exp[-80000/RT]≈1.4×10-39 (14.1)
其中2.7×1019为通常情况下毎毫升气体中分子总数的约值。(14.1)式表明一个活化分子也没有。其单分子反应速率约为(取单分子反应的指数前因子为1013s-1这一“正常”值):
1013×1.4×10-39=1.4×10-26分子·毫升·秒-1 (14.2)
即约每经历约7×1025秒或2×1018年オ有一个分子反应,而与此对比的是地球的年龄“仅”约1017秒。而一定要说,在这种情况下反应仍在缓慢进行就未免过于迂腐。而且即使对于活化能为60kcal·mol-1(约为250kJ·mol-1)左右的反应(这类反应并不罕见),室温下每毫升中只有约10-24~10-25个活化分子:如此小的数,早已超出了统计规律的范畴以外。因此,可以说;在此情况下,这类反应实际上根本不进行。如果硬要说反应还在缓慢进行,就如同说:一室中的气体在某一瞬间可能自动集中到室内某一局部空间一样(虽然这种“可能”的极小的几率可以计算出来)是十分荒谬的。事实上,由热力学观点,一反应物可以允许进行的反应往往是多种的,在适当的反应动力学条件(如存在适当的催化剂的条件)下,只有某一种或某几种反应进行,其它可能的反应,其基元化学物理反应一个也未进行时反应物已消耗殆尽,对于这些未进行而热力学允许进行的反应显然不能说是在缓慢进行。所以这样论述也得不出任何与热力学相背驰的结论。
催化剂只能加速达到而不能改变平衡的状态。这意味着催化剂能够同时加速正向与逆向反应。但应该注意,这系指在同一条件下的加速。对于反应条件不同的正向与逆向反应来说,适用的催化剂往往是不同的。例如:脱水反应与水合反应使用的催化剂一般是不相同的。
已经指出,催化剂是化学反应的积极参与者,由于催化剂的存在往往改变反应机理,其表观特征常常是其活化能下降,例如:过氧化氢在水溶液中的分解反应(0~50℃),其表观活化能在无催化剂时为70~80kJ·mol-1。当以碘离子或铁离子为催化剂时约为50kJ·mol-1,而在以某些酶作为催化剂时仅为每摩尔数千焦。不仅如此,由于催化剂的作用使反应机理变化,反应级次以及反应速率方程的形式都可以有变化,这种情况在液相的催化反应中是常见的。
当催化剂浓度不太大时,催化剂对反应速率的影响常与其量成正比(其它对比条件相同)。例如:一化学反应当无催化剂时其反应速率常数为k0,那末当催化剂浓度为c时,其表观反应速率常数为:
k表=k0+kcc (14.3)
其中kc为与催化剂浓度无关,由催化剂本性及温度确定的常数,常称为比催化活性。其本质上也是催化反应的速率常数。反应过程中催化剂浓度c恒定,k表为一常数,反应的时间级次不依赖于催化剂。但其浓度级次与催化剂有关。若以k表对c作图应得一直线。例如:在盐酸-氯化亚铜作用下,4-氯化丁二烯1,2的催化异构化反应:
CH2=C=CHCH2Cl → CH2=CCl-CH=CH2 (14. 4)
是一个一级反应(时间级次),在催化剂(氯化亚铜)的不同浓度c下,测得其表观反应速率常数k表,再以k表对c作图可得如图43所示直线。此直线通过原点,表明无催化剂时反应基本上不进行(k0为零)。也有的反应,k表与c之间的关系直线并不通过原点。如图44所示即为以不同的有机酸钠为催化剂时葡萄糖变旋反应的表观反应速率常数k表依催化剂浓度变化的直线。如所预期,其截距k0与催化剂无关,对不同的催化剂有同一的截距,但其斜率kc依催化剂不同而各异,即对不同的催化剂可以得到具有不同的斜率,而相交于纵轴同一截距k0的直线。
许多反应物往往可以由于选择的催化剂不同而进行(或主要进行)某种不同的反应,称之为催化剂的不同选择性。例如:乙醇在氧化铝上进行脱水反应,在铜制催化剂上进行脱氧反应,在其他一些催化剂上还可以进行一些不同的复杂过程(如生成丁二烯等),有的催化剂有高度的选择性只能加速一定的反应(如酶催化等)。有的催化剂则可以加速许多不同的反应(例如:铂催化剂可以加速氧化、加氢、脱氢、聚合等许多反应),也有的反应可以为许多催化剂所加速(例如:二氧化硫的氧化所用的催化剂有铂、二氧化氮以及钒或铁的氧化物等)。总之,催化剂的选择性是一个颇复杂多样的问題。
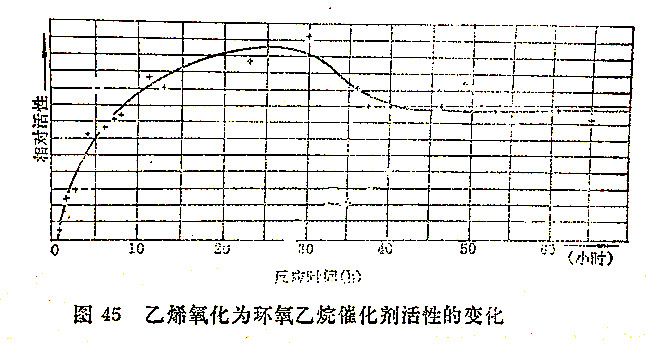
催化剂对于少量杂质十分敏感,有时添加少量杂质可以使催化作用大大加强(助催化剂)或大大削弱(毒物)。不仅如此,同样化学組成的催化剂由于制备方法的差异,导致物理性质(如晶体结构与颗粒大小等)不同,对催化作用能力也可以有巨大的影响,催化剂使用过程中物理形态的变化也会影响共催化能力。这对复相催化过程尤为明显,有的催化剂在使用过程中活性下降很快,要频繁地再生(如裂化反应),有的催化剂开始使用时,催化活性不稳定,要使用一段时间后可以达到比较平稳的催化活性,如图45所示为乙烯在一种银催化剂上氧化为环氧乙烷的反应之例。催化剂的敏感性对于催化反应动力学的研究是必须密切关注的。