








在无机分析里,氧化性化合物的最好判断根据,是它們从碱金属碘化物酸性溶液中釋出碘的能力。这个效应,自然只可希望这些化合物本身或其反应产物是能在稀酸中有显著溶度的氧化剂,才能发生。在某些有色醌类与醌亚胺化合物,过氧化氢的有机衍生物(无色的),有机碱类与无机酸所生成的盐类等事例中,这个效应是可以肯定的;这些本身都是能使氢碘酸(氯酸盐、铬酸盐、钼酸盐、磷钼酸盐等)被氧化的。这种能使碱金属碘化物酸化溶液迅速氧化的有机化合物,其范畴包括烷基胂酸类、芳基胂酸类及烷基䏲酸类、芳基䏲酸类、C-亚硝基化合物类及N-亚硝基化合物类、阿脲、以及羧酸与磺酸的卤胺类。

在酸溶液里,过氧化氫与碘离子之間的氧化还原反应,进行得太慢,不能充作有机过(per)化合物通用試驗法的基础,因这种过化合物和水接触,即会被水解。可是如果将黑色硫化鉛被氧化为白色硫酸鉛这一氧化过程,作为对过氧化氢一个很灵敏点滴试驗来进行,倒是极适合于这个用途。由于有机过化合物实际上很少存在,此处不拟对这个試驗作精細的叙述。二苯酰化过氧是过氧化氢的一种有机衍生物,既不对酸化的碘化物,也不对硫化铅发生感应。
氢氧化亚铁的氧化
水溶或醇溶的氧化剂和绿色氢氧化亚鉄悬浮液反应,可观察到特性的效应。硝基与亚硝基化合物也有此同样的功用,它們都参与下列氧化还原反应,且由于有氢氧化铁形成,就可从绿色变到棕色将它們显示出来。
RNO2+6Fe(OH)2+4H2O → RNH2+6Fe(OH)3
RNO+4Fe(OH)2+3H2O → RNH2+4Fe(OH)3
可被苛性碱分裂的那些胲与肼的有机衍生物,同样能使氢氧化亚鉄氧化。这种性行是根据胲与肼(亚硝酸盐也是一样)在有碱金属氫氧化物一起存在时,正常都是还原剂,却会被氢氧化亚鉄还原为氨;因此,它們对这还原性氢氧化亚鉄,其功用則似氧化剂。
在适当条件下,硝基与亚硝基化合物,可被初生态氫还原,其所生成的化合物,却因其对托倫斯(Tollens)与費林(Fehling)試剂有还原作用,而可作出检定。
应注意到本試驗中,颜色由綠变棕,仅在有色化合物不存在时才能看得清楚。下列的操作手续,可推荐用于試驗小量硝基与亚硝基化合物等。
操作手续 取新制成的0.1%硫酸亚鉄铵在10%硫酸中的溶液一滴,放在小試管内,用試液一滴,和以水,酒精、或二口恶烷共同处理,然后加入一些固体的碳酸氢鈉。这样,备足了碱性和阻止氢氧化亚鉄自动氧化的二氧化碳气氛。
下列各物給出正反应:
30微克 硝基苯
25微克 对硝基氯苯
25微克 邻硝基苯甲酸
30微克 5-硝基水楊酸
硫代米奇勒氏酮或四碱的氧化
在中性介质中具有活性的有机氧化剂,都可用黄棕色的硫代米奇勒氏酮〔4,4'-双-(二甲胺基)-二苯甲硫酮〕或四碱(四甲基替对,对'-二氨苯基甲烷)作出檢定。这些叔碱类被氧化时,将产生蓝色醌型化合物。
硫代米奇勒氏酮被氧化的化学根据,在之前文章中曾結合单体卤素的試驗法作过概述。四碱被氧化时,会有二苯基甲烷染料生成:
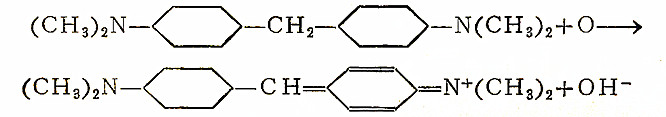
与这两种試剂发生反应的化合物包括:有机碱类的多卤化物及其和氫卤酸所生成的盐;苯醌及四卤化苯醌;过酸或其酸酐;可視作次卤酸衍生物的一羧酰和二羧酰的卤亚胺和卤胺。
奇怪的是,氯胺B(氯胺苯砜的鈉盐)和氯胺T(氯胺-对-甲苯砜的鈉盐)能和硫代米奇勒氏酮反应,但不和四碱反应。
过-化合物之具有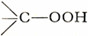 基团、胂酸类及胺的氧化物类,与大多数方才所举的化合物相似,能迅速地从酸化碱金属碘化物溶液中釋出碘,但既不与硫代米奇勒氏酮反应,也不与四碱反应。这与(a)中所列能使氢氧化亚鉄被氧化为氢氧化鉄的化合物一样。
基团、胂酸类及胺的氧化物类,与大多数方才所举的化合物相似,能迅速地从酸化碱金属碘化物溶液中釋出碘,但既不与硫代米奇勒氏酮反应,也不与四碱反应。这与(a)中所列能使氢氧化亚鉄被氧化为氢氧化鉄的化合物一样。
操作手績 这里使用試剂紙,其制法是将定量滤紙浴浸于0.1%硫代米奇勒氏酮的苯溶液中,或浴浸于2.5%四碱的醚溶液中。如果隔絕空气,干的試紙是稳定的。如将試液一滴放在黄色或无色的試紙上,在溶剂蒸发后,就会有蓝色斑迹或环圈出現。
氫氧化亚铊的氧化
在强碱性溶液中具有活性的有机氧化剂,可通过碱性铊(Ⅰ)溶液中生成水合氧化铊(Ⅲ)的棕色沉淀而作出檢定:Tl++O+OH- → TlOOH。屬于这一类的化合物是极少的,例如:卤亚胺类,如溴替-(氯替-、碘替-)琥珀酰亚胺,即使在室温下也有反应,而氯胺T及其有关化合物,只在加热时方有反应。如果作成点滴反应在滴試板上或在微量試管中进行,就有可能用4%硫酸亚铊的碱性溶液,檢定出2.5微克氯胺T或3微克溴替丁二酰亚胺。