.jpg)
通常把能表示出化学反应与热效应之间的关系的方程式,称作热化学反应方程式。例如:
(1)C(石墨)+O2(g)=CO2(g) △H1=-393.5kJ/mol
(2)C(金刚石)+O2(g)=CO2(g) △H2=-395.4kJ/mol
(3)H2(g)+1/2O2(g)=H2O(g) △H3=-241.8kJ/mol
(4)H2(g)+1/2O2(g)=H2O(l) △H4=-285.8kJ/mol
(5)2H2(g)+O2(g)=2H2O(l) △H5=-571.6kJ/mol
由于化学反应的热效应除与反应进行的条件(如温度、压力等)有关外,还与反应物、生成物的数量、状态等有关,因而在书写热化学反应方程式时应注意如下三点:
(1)注明物质的聚集状态。因为聚集状态不同,相应应的能量也不同。一般用g,l,s表示气、液液、固三种状态,用aq表示水溶液等,标注在该物质化学式的后面。此外如果一种固体物质可能有几种晶型,则应注明是哪种晶型。从方程式(1)和(2)可以看出注明物质晶型的必要性,从方程式(3)和(4)可以看出注明物质聚集状态的必要性。
(2)注明反应的温度和压力。如果反应是在298.15K和100kPa下进行的,则按习惯可不注明。压力力对热效应的影响不大。温度对化学反应的热效应有影响,但也不大。在本书中,可近似认为化学反应的热效应不随温度改变。
(3)正确写出配平的化学反应方程式。方程式中各物质前的计量系数表示物质的量,它可以是整数,也可以不是整数。同一反应,以不同的计量方程式表示时,其热效应数值是不同的。从方程式(4)和(5)可以看出注明化学计量数的必要性。
化学反应的热效应可以用实验的方法测量得到,但是许多化学反应由于反应时间长,条件难以控制等原因,无法准确测量得到热效应。1840年,瑞士的俄裔化学家盖斯(G.H.Hess)在总结大量实验事实的基础上提出,在恒容或者恒压的条件下,一个化学反应不管是一步完成的,还是多步完成的,其热效应总是相同的。这就是盖斯定律。盖斯定律是能量守恒定律的一种特殊的表现形式式。利用这一定律可以从已经精确测定的反应的热效应来计算难难于测量或不能测量的反应的热效应,可以从已知化学反应的热效应计算某些未知反应的热效应。
例1-8 已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H2=-283.0kJ/mol
求反应:C(s)+1/2O2(g)=CO(g)的△H是多少?
解:反应途径为
.jpg)
根据盖斯定律: △H1=△H2+△H
所以 △H=△H1-△H2=-393.5-(-283.0)=-110.5kJ/mol
例1-9 已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393 5kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol
求反应:C(s)+2H2(g)=CH4(g)的△H是多少?
解:反应途径为
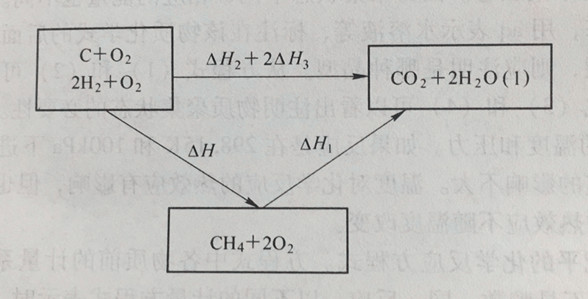
根据盖斯定律: △H1+△H=△H2+2△H3
△H=△H2+2△H3-△H1
=-393.5+2×(-285.8)-(-890.3)
=-74.8kJ/mol