元素的原子半徑和离子半徑
铜臭 / 2022-08-12
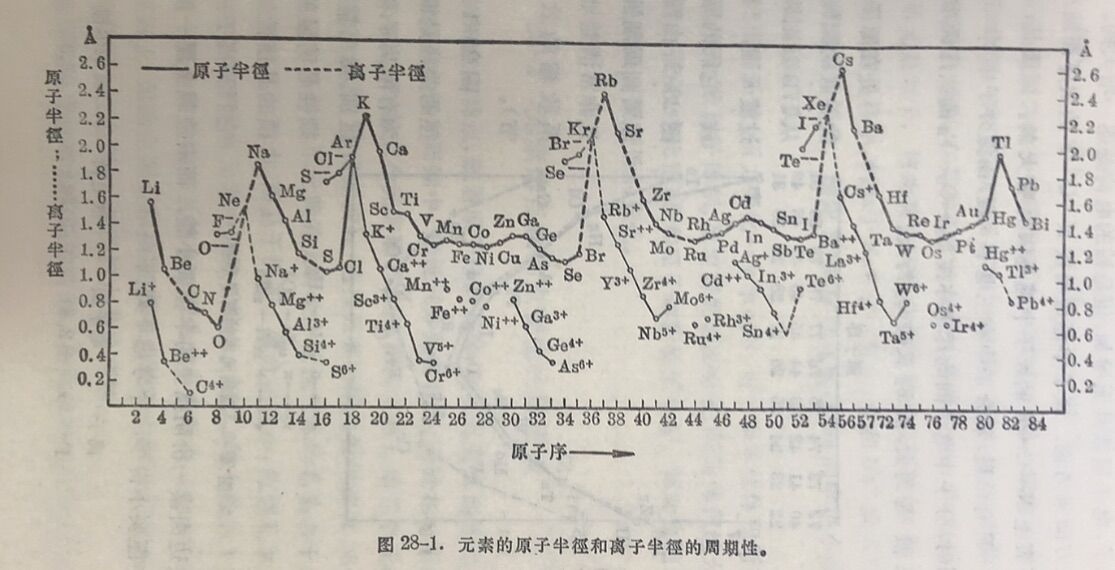
元素原子的基本性质之一是它們的大小。 图28-1表示了元素的原子半徑和离子牛徑的周期性变化。在原子半徑的曲线中,容易看出碱金属在曲钱上占有峰頂的位置。它們的原子半径最大,因为新增了一个s电子,就是新增加了一个电子层,而同时核电荷又增加了一个单位。在碱土金屬的原子中,最外是两个s电子,壳层并未增多,而核电荷则又增加了一个单位,因此发生收縮,其他依此类推。一方面电子增多和壳层增加有着使原子增大的趋向,而另一方面核荷增加又因引力增大而有使原子缩小的趋向。这两种矛盾着的趋向相互竞爭,要看哪一个占优势而决定原子半徑随原子序的递增而增大或减小。但是在碱金屬前的几个元素处,原子半徑已逐漸由谷底向峰頂上长,理由如下。
实际上,原子半徑一般是从晶体求得的, 因此,在相当程度 上受到晶格的影响。一般非金屬元素, 是分子晶格型的。那么在分子中原子的如何结合,也影响。例如N-O-F三个元素,論到它們的原子结构,都是在2p电子层中逐一增加
电子,电子层数幷无增加,但是核的电荷是逐一增大的。如果单从 这方面来考虑,原子半徑应当按N-O-F 的次序而箱小。但是, 事实上N-O-F的原子半徑是依次增大的。原因是,氟分子中 F-F有单鍵,氧分子中有三电子π键,而氮分子中N≡N有三键。 同时,分子中电子間的斥力亦按N₂-O₂-F₂的次序而增大。结果O₂較N₂为大,而F又較O₂为大。
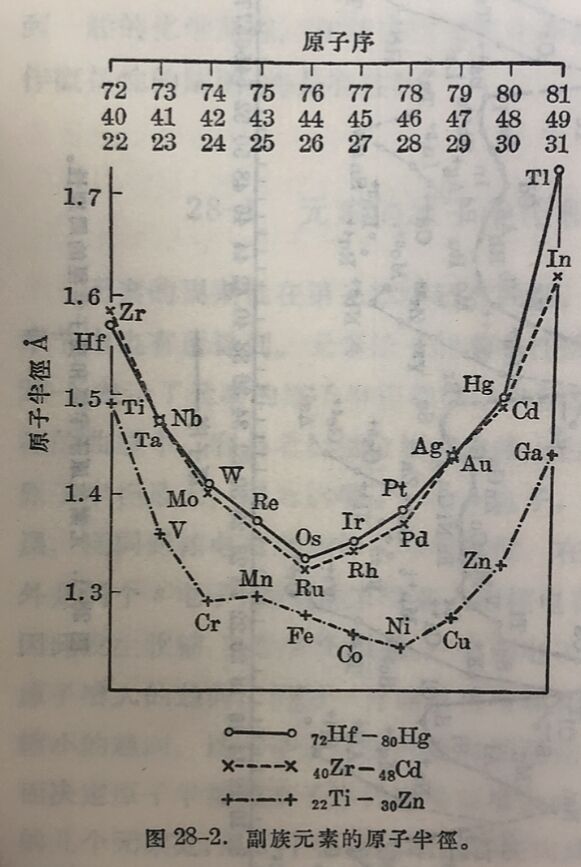
处在原子半徑曲钱的谷底的副族元素,即从IVB鈦副族起,通过过渡元素,到IIB鋅副族,它們的原子半徑見图28-2。由图中不但可以看到周期性变化,并且非常清楚地看到了鑭系收箱的效应。
图28-1中离子半徑的曲棧是断开的,因为有阳离子和阴离子的区别。然而整个看来,周期性是明显的。占在峰頂的是惰性气体(暫把它們和离子一并而論),左边卤素一价阴离子的半徑要小些,而右边碱金属一价阳离子的半徑要小得多。今考虑下列例子:
| 离子 |
电子层 |
核电荷 |
离子半径 |
|
F-
Ne
Na+
|
2,8
2,8
2,8
|
9
10
11
|
1.33
1.59
0.98
|
Na⁺比Ne小,是因为鈉的核荷增加了一一个 单位。那么氟的核电荷比氖小一个单位,为什么F⁻反而比Ne小呢?理由是,这些数据是由晶体求得的,因此在某种程度上依赖于晶体结构。Ne在晶格中的结构单元是原子,彼此間依靠弱的范德瓦尔力相结合,而F⁻是存在于离子型晶格中,例如于NaF和KF中,它和Na⁺或K⁺离子間有着强的庫命引力,因此F⁻的半徑反而比Ne的半徑小些,但是毕竟要比Na⁺大。
此外,压縮系数(压力变化一个单位时,对个单位体积所产生的体积减小)也象原子体积,呈现着周期性变化,因为体积越大,越容易压縮。密度(或比重)是和原子体积呈反比的,因此也随着原子序的递增而有周期性的变化。