鈦
铜臭 / 2022-08-06
一、鈦的存在和提取
鈦的主要矿物有金红石TiO₂和鈦铁矿FeTiO₃。其次是粗成复杂的釩鈦铁矿,它主要含有鈦铁矿和磁铁矿两种矿物。鈦的其他矿物有钙鈦矿CaTiO₃和楊石CaTiSiO₅等。
一般由鈦铁矿中提取鈦。釩鈦铁矿可用磁选法除去磁铁矿, 而得鈦精砂。处理鈦铁矿通常用两种方法一硫酸法 和氯化法。在前一方法中,将濃硫酸和磨細的矿石共热,
FeTiO₃+2H₂SO₄=TiOSO₄+FeSO₄+2H₂O
然后将固体产物加水,并加铁屑以保持Fe呈二价,在低溫结出大 部分FeSO₄·7H₂O后,稀釋加热,使鈦化合物水解,得沉淀Ti(OH)₄,后者加热即轉化为TiO₂。氯化法是将矿石和炭加热使之熔融,以氯处理:
TiO₂+C+2Cl₂=TiCl₄+CO₂
制金屬鈦可用鈣或鈉将二氧化鈦在氢气氛中还原。比較方便的一个方法是用熔融的鎂还原四氯化鈦,作用也在氬气中进行:
TiCl₄+2Mg=Ti+2MgCl₂
蒸去MgCl₂和殘余的鎂,得海锦状鈦。再通过电弧熔融或成应熔融,制得鈦錠。
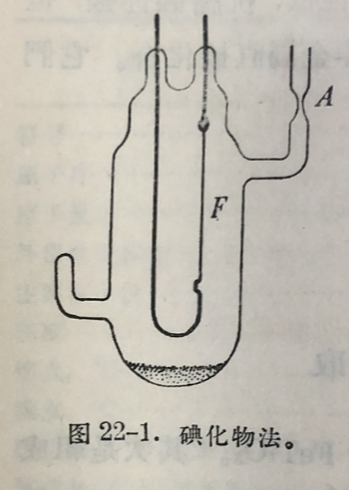
最純的鈦是用碘化物法(或称灼热稳分解法)制备的。碘化鈦热分解的装置見图22-1。管子用特硬玻璃吹制。管底装粉末状粗鈦,并放入少許碘。将管子中的空气抽空,在A处熔封。然后通电将一条极细的鎢丝F妁热至1300°C。管子預热到130°C。粉末缺和碘作用生成Til₄,后者的蒸气在鎢籍上分解,结果晶体鈦沉积在鎢称上。这样所得的鈦,純度在99.95%以上,具有展延性。
此外,也督有过用熔融的鈦盐进行电解以制备金屬鈦的尝試。
二、鈦的性质和用途
鈦的特性是密度小、机械力强、容易加工。鈦的塑性与其稿度有关鈦越純塑性越大。液体鈦几乎能溶解所有的金局,因此可以加入一.些合金金局进去,以改变鈦的性能。加入7%Mn于鈦中可使其抗拉力加信。
但是,鈦的最重要性质是具有优越的抗腐蝕性。它在空气中 加热到500-600°C时还稳定, 在氧气流中加热到紅热时則燃燒。在800°C以上时,鈦和氧化合。鈦不与潮湿的氣、氯化物溶液以及象硝酸那样的酸或王水作用。在室温时它也不和稀硫酸以及稀盐酸作用。氢氟酸、磷酸、中等浪度的强碱使蝕鈦,但稀的强碱对鈦不起作用,最突出的是鈦对海水的抗触性很强,因此可应用于航海业中。
以前鈦用来制“铁鈦”合金,加入鋼中制成“鈦鋼”,其中鈦的含量少于0.1%。鈦鋼坚韌而有弹性,因为鈦能与析出的氧和氮(当鎘冶下时)化合。由于金屬鈦具有上述的优良性能,自从本世紀四十年代以来,它的生产量激增。因此鈦享有“未来的金属”的称号。目前特别是用在噴气式飞机的制造上。它可以耐高溫达400°以上。其他用途是在航海設备、机器零件等制造方面。鈦又用来制造銅、鎳和鋁的合金。粉末状鈦用在电子管制造业中作为除氧剂。