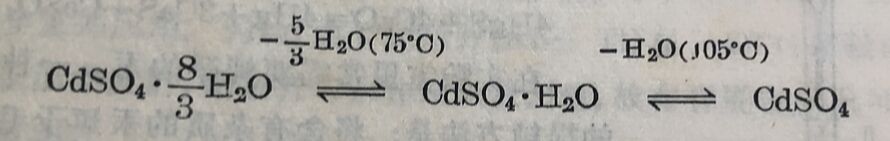鎘
铜臭 / 2022-08-04
一、鎘的存在和冶炼
鎘在自然界与锌共生。閃鋅矿等都含有隔,不过即使精矿最 多也只含鳎1%,一般含 0.2%-0.4%。
焙燒鋅矿时,烟道灰中含有2.5%的鎘,用稀硫酸处理后加入鋅粉可将鎘置換出来。另外还可用电解法,鎘的沉积电压比鋅低,控制电压为2.6伏,鎘先析出。这样制得的鎘純度为99.95%。用在标准电池中的鎘,純度要求更高,需經过反复的电解和在其空中升华等純化过程。
二、鎘的性质和用途
鎘是白色金屬,比鋅軟一些,有展性。
鎘能和其他金屬形成合金,如在铜中加入少量鎘,能增加銅的机械强度,但不降低銅的导电性。把鎘鍍在金屬表面上可防止生銹。此外,鎘現在也用在原子反应堆中作控制棒,因为它吸收中子的效率高。
鎘在潮湿空气中綬慢地氧化,如加热則燃燒而发生紅色火焰。 鎘与卤素在高温下作用剧烈,与硫也可直接化合。 在盐酸和硫酸中溶解慢;与硝酸作用較快。与鋅不同,鎘不能溶于强碱中。
三、鎘的化合物
鎘在化合物中主要表現为+2价。大多数的鎘盐是白色,并且易溶于水。可溶的盐有毒。鎘形成絡合物的傾向很显著。
1.氧化鎘和氫氧化鎘
在空气中燃燒鎘,得到棕色的氧化鎘。由于制备的方法不同,颜色也各异,如在250°,将氨氧化鎘加热,得到綠黄色的氧化鎘,在800°加热,則得到藍黑色的氧化鎘。它可以升华,而不分解。和氧化鋅不同,它具有氯化鈉型晶格,不溶于水,与酸作用形成鎘盐。
将氨氧化鈉加大鎘盐溶液中,即有白色的氫氧化鎘Cd(OH)₂析出。它溶于酸,但不溶于碱。氫氧化鎘 也和Zn(OH)₂一样溶于氨水中形成貉离子:
Cd(OH)₂+4NH₃=[Ca(NH₃)₄]⁺⁺+2OH⁻
2.卤化鎘
在隔盐常液中加入须化铵,有氟化鎘析出。其它的卤化物均以氢氧化鎘和氢卤酸作用而制得。
氟化鎘和氯化镉是白色,溴化镉是黄色而碘化镉是棕色,其中以氟化镉的熔点和沸点为最高(表20-5)。除氟化鎘微溶于水外,其他卤化编在水中易溶,溶解度依Cl-I的顺序而降低。氟化锯和碘化鎘为无水化合物。在不同的秸晶条件下,氯化鎘和溴化鎘 形成各种水合物,最常見的是CdCl₂·2.5H₂O和CdBr₂·4H₂O。
电导实验证明,卤化鎘在水溶液中电离并不完全:
CdX₂⇔CdX⁺+X⁻
而且在濃溶液中有明显的自絡合倾向:
2CdX₂⇔Cd⁺⁺+[CdX₄]⁻
表20-5 卤化镉的性质
| 性质 |
CdF₂
|
CdCl₂
|
CdBr₂
|
CdI₂
|
|
颜色
熔点,°C
沸点,°C
比重
溶解度,克分子/升
水合物,水分子数
|
白
1100
1747
6.6
0.29(25°)
—
|
白
868
960
4.1
7.7(20°)
4、2.5、1
|
黄
568
1136
5.2
4.2(20°C)
4、2
|
棕
387
升华
5.7
2.3(20°C)
—
|
卤化镉与碱金局卤化物在溶液中形成络合物,主要的是M⁽ᴵ⁾[CdX₃]塑其大还有M₂⁽ᴵ⁾[CaX₄]型和M₄⁽ᴵ⁾[CaX₆]型。
3.硫酸鎘
将碳酸锯溶于稀硫酸中得硫酸解。最常见的水合物为 3CdSO₄·8H₂O还有CdSO₄·H₂O。七水合物CdSO₄·7H₂O是介稳定。水合物的轉变和轉变温度列于下式:
鎘的无水硫酸盐的溶解度比鋅大,在25°每100克水溶77.2克盐。温度的变化对于它的溶解度影响不大,故用于制备标准电池。和硫酸鋅相似,它与碱金屬硫酸盐形成复盐,M₂ᴵSO₄·CdSO₄·6H₂O。电导实驗表明在濃的溶液中它也发生自絡合作用。
4.硫化鎘
在自然界存在的是硫鎘矿Cds。以硫化氫通大鎘盐溶液中,有黄色的硫化鎘Cds析出:
Cd⁺⁺+H₂S=CdS+2H⁺
它微溶于水,溶度积为3.6×10⁻²⁹(18°C),比硫化鋅的溶解度小,在稀盐酸中不溶解,而只溶于濃盐酸或硫酸中。与稀硝酸共热时,S⁼被氧化为S:
3CaS+2NO₃⁻+8H⁺=3Cd⁺⁺+2NO+3S+4H₂O
硫化鎘是有用的顏料,称为鎘黄。在制备蛰光体时,也用到硫化鎘。