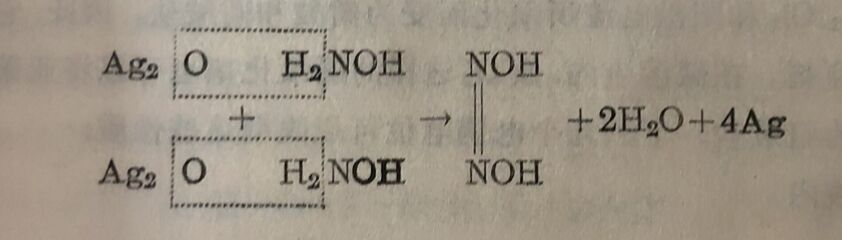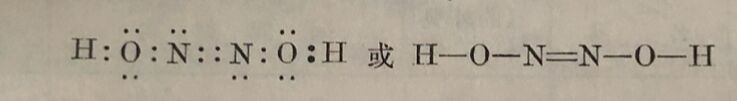氮的含氧酸和含氧酸盐
铜臭 / 2022-07-26
氮的含氧酸中以硝酸HNO₃为最稳定和最重要。它的盐称为硝酸盐M'NO₃。它的酐是五氧化二氮,称为硝酐。亚硝酸HNO₂不稳定,只存在于溶液中。亚硝酸盐M'NO₂較稳定。亚硝酐是三氧化二氨,在常温时,与NO及NO₂处于平衡中。
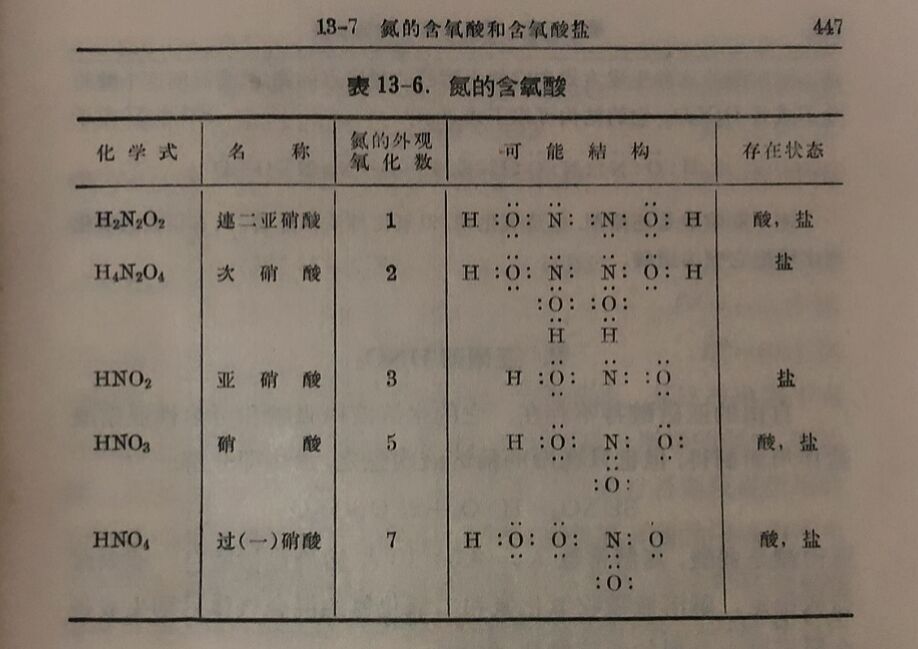
氮在硝酸内可看作是正五价的,在亚硝酸内是正三价的。氮 的含氧酸的进一步还 原就产生速二亚硝酸H₂N₂O₂,在其中氨显正一价。但从該酸的秸构看(表13-6)氮是三价。連二亚硝酸存在于自由状态,但很不稳定,它的盐較稳定。以氮的氧化态看,次硝酸H₄N₂O₄是介乎連二亚硝酸和亚硝酸之間的一个中間状态,这种酸的自由状态不存在,它的碱金属盐已經制得,可在液体氨内存 在。此外,将硝酸O₂N-OH內的氢氧基以过氧基- -OOH 代替, 則得过硝酸O₂N-OOH或HNO₄。实际上,以纯过氧化氧与五氧 化二氨在-80°C作用則产生过硝酸,不过它不稳定,虽在-30°C也猛烈分解,发生爆炸。在溶液内用等克分子的H₂O₂与HNO₃混合以制备过硝酸则所得产物稳定,也較完全。現在把氮的含氧酸連同它們的秸构汇列于表13-6丙。本节討論将限于硝酸、亚硝酸和連二亚硝酸。
1. 連二亚硝酸H2NgO2
自由状态的連二亚硝酸是白色片状晶体,干燥时极易爆炸,溶于水則較稳定,但仍依下列反应逐渐分解:
H₂N₂O₂=H₂O+N₂O
这个作用是不可逆的,氧化二氨N₂O因而不能认为是連二亚硝酸的酐。它 的水溶液显弱酸性(K₁=9x10⁻⁸, K₂=1x10⁻¹¹, 在25°C)。它的正盐M'₂N₂O₂是稳定的,但在水溶液内則几乎全部水解。
用鈉汞齐或氯化亚錫使亚硝酸盐在水溶液内还原,即得連二亚硝酸盐,其反应为
2NaNO₂+ 2SnCl₂+4HCl= Na₂N₂O₂+2SnCl₄+2H₂O
另一制备法是用金属氧化物使羥氨基氧化:
連二亚硝酸的这种生成方式和它的水溶液的凝固点的测定,皆說明这个酸的分子式是H₂N₂O₂,它的秸构可以下式表示:
連二亚硝酸是还原剂,也是氧化剂,但氧化性质較显著,只有很强的氧化剂才可把它变为硝酸。






























![硝酸铜标准溶液 c[Cu(NO3)2]= 0.01000 mol/L价格](images/202207/thumb_img/1653_thumb_G_1658537651764.jpg)






















![1,5-二氮杂双环[4.3.0]壬-5-烯 DBN](images/202306/thumb_img/5107_thumb_G_1688093666688.jpg)