极化和超电压
铜臭 / 2022-07-23
一、极化
实际分解电压大于理论分解电压的现象称为极化。这说明除了电解产物所组成原电池的反电动势外,还有一些因素阻碍着电解的进行,必须加高外加电压来克服这些因素。产生极化作用的主要原因有以下三方面:
1.电阻极化。电解时由于电解质溶液、导线和接触点等具有-定的电阻(R),要使电流通过,必须增加外加电压去克服IR的电位差。有时由于在电极表面上存在一层电阻较大的薄膜(如金属的氧化膜、气膜等),对电流的通过产生阻力,也需要增加一部分外加电压去克服它。
2。浓差极化。电解时电极附近的离子浓度常和溶液本体中的浓度有差别,例如用两个银电极电解AgNO₃溶液时,溶液中的Ag⁺向阴极迁移并在阴极上放电,发生Ag⁺+e=Ag的反应。在阴极附近溶液中的Ag⁺不断还原成金属Ag,并不断从溶液本体中迁移来的Ag⁺得到补充。如果溶液本体中的Ag⁺迁移到电极表面附近的速度赶不上Ag沉积的速度,则阴极附近Ag⁺的浓度将小于本体溶液中Ag⁺的浓度,结果阴极电位将小于按溶液本体浓度计算所得的值,即阴极电位比理论电极电位要负一些。同理, 在阳极上发生的是Ag -e=Ag⁺的反应,如果阳极附近Ag°⁺向溶波本体迁移的速度赶不上Ag溶解的速度,则阳极附近Ag⁺的浓度将大于溶液本体中Ag⁺的浓度,结果使阳极电位比理论电极电位要正一些。这种由于离子浓度不均匀引起的极化称为浓差极化。浓差极化可以用搅拌或升高温度等方法使之减小,但由于在电极表面上存在一扩散薄膜而不能完全消除。
3.电化学极化。对于许多电极过程,尤其是有氢、氧等气体析出的过程,电解产物的析出电位比理论电极电位要大一定的值,这种情况被认为是电极反应的迟缓性引起的。电极反应可能是分几步进行的,如其中有一步需要较高的活化能时,则这步使整个反应速度缓慢,阻碍了电极反应的进行。为了克服这种阻力,以维持电极反应以一定的速度进行,就需要提高外加电压,这种极化称为电化学极化。它是极化作用中最重要的一种,并且不能用简单的方法消除。
由此可知,电解质溶液的分解电压除要克服由电解产物形成原电池的反电动势外,还必须克服上述这些极化作用,因此它必大于理论分解电压。
二、超电压
在电解时,由于电化学极化所需增加的那部分额外的外加电 压,称为超电压( η )。由于电化学极化引起的实际析出电位与理论析出电位的偏离(取绝对值),称为该析出物的超电压。例如氢在1N的酸液中理论析出电位为零,而在消除浓差极化后氢在镍片上的实际析出电位为-0.3伏,则氢在镍片上的超电压为0.3伏。由于电化学极化引起阳极电位对其理论电位的偏离,称为阳极超电压(η₊),阴极电位对其理论电位的偏离,称为阴极超电压(η₋),η₊与η₋都取绝对值,则:
η=η₊+η₋
在电解池中,阳极电位较其理论电位正,阴极电位较其理论电位负,即:
φ阳=φ阳,理+η₊
φ阴=φ阴,理-η₋
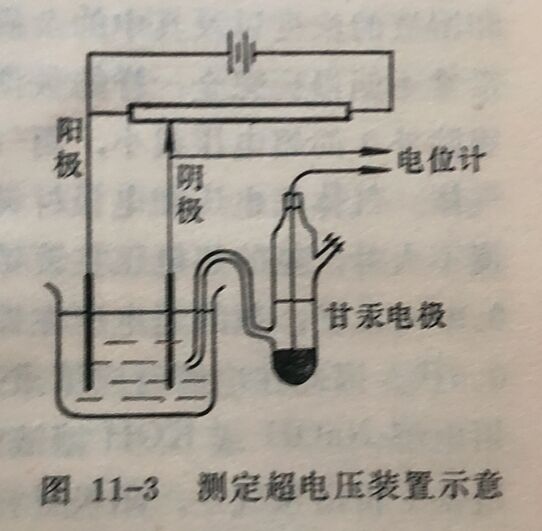
1.超电压的测定。测定超电压实际上就是测定在有电流通过 电极时的电极电位,图11-3是测定 超电压装置的示意图。在电解池中,除阴、阳极外,再放入一个甘汞电极。把甘汞电极与电解池中某个待测电极(阴极或阳极)组成一原电池, 并连接到电位计和供测量用的电源上,组成另一回路,以测定电极电位。调节电解外电路中的电阻,即可改变通过待测由电流计A上读出)。在通过电解电极电流的大小(即电解电流,可池的电流大小不同时,测定由甘汞电极与待测电极构成的原电池的电动势,由于甘汞电极的电极电位是已知的,即可求得待测电极的电极电位。为了降低甘汞电极和待测电极之间溶液的电阻电位降,将甘汞电极的一-端做为毛细管并使它与待测电极靠得很近。在电解池中应装一搅拌器以消除浓差极化。将测得的电极电位和由能斯脱公式计算得的理论电位相比较,两者之差,即为待测电极的超电压。
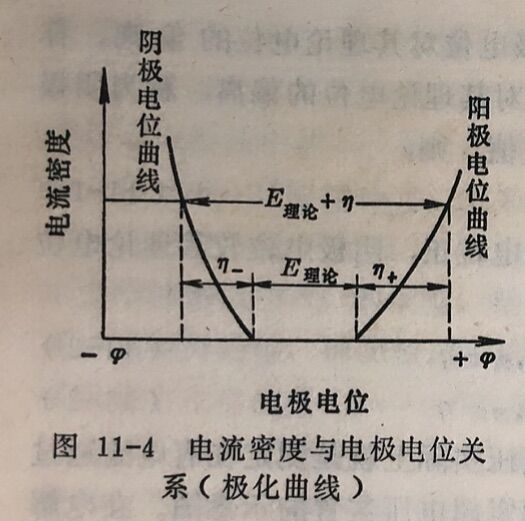
2.超电压与电流密度的关系。若电极上电流密度(单位面积上通过的电流强度)不同时,电极电位也随之而改变,超电压也随 之而变化。如上述实验时,每改变一次电解电流, 就测定一次待测电极的电极电位。以电极电位为横坐标,电流密度i为纵坐标作图,就可得到图11-4所示的电流密度与电极电位的关系曲线,称为极化曲线。
从图11-4中可以看出超电压随着电流密度的增大而增大,当电流密度增大时,阳极电位向更正的方向偏离,阴极电位向更负的方向偏离。