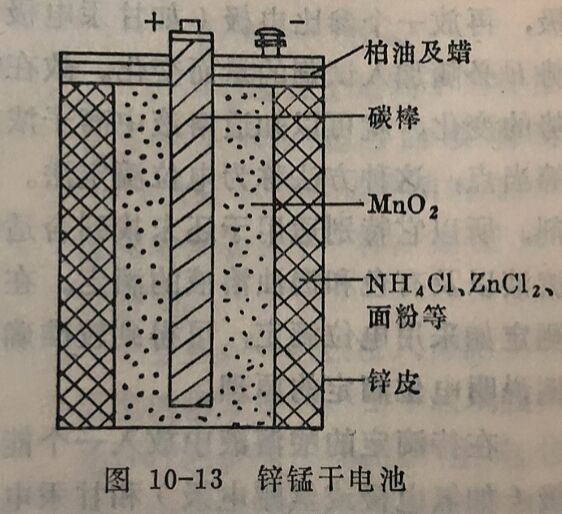
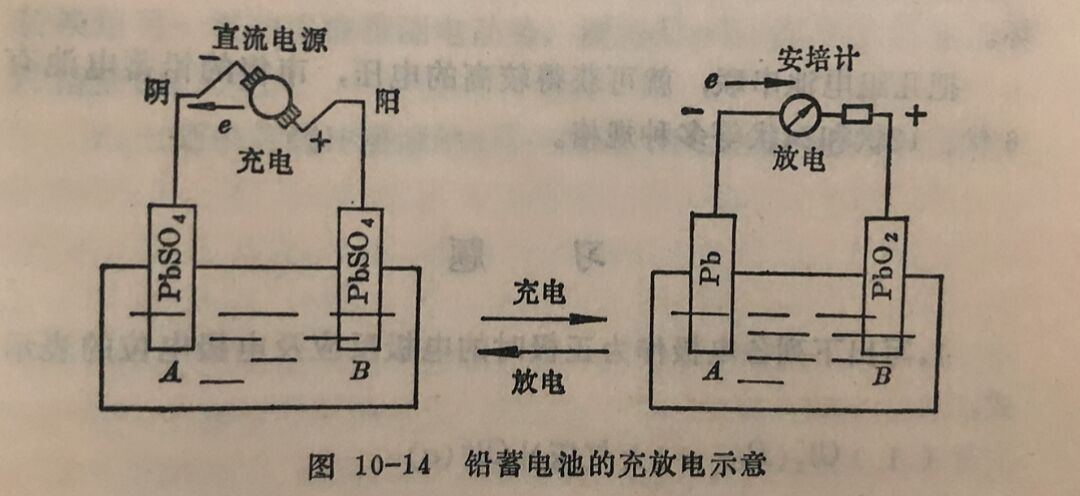
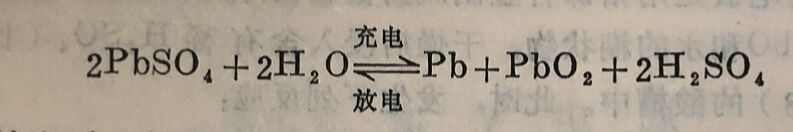A板(负极): PbSO₄+2e=Pb+SO₄²⁻
B板(正极): PbSO₄+2H₂O-2e= PbO₂+4H⁺+SO₄²⁻这样随着充电过程的进行,PbSO₄在 A板变成蓬松的金属铅,在B板变成PbO₂,而在溶液中有H₂SO₄生成。因此,测定铅蕾电池内H₂SO₄溶液的比重可判断充电的程度。充电完毕后,铅蓄电池中每对电极,即每个电池的电动势约为2伏,H₂SO₄液的比重在1.22~1.28之间。充电后的蓄电池可表示为:
Pb|H₂SO₄|PbO₂,Pb
放电时蓄电池即成为原电池,两极上的反应是:
负极(A板): Pb-2e+SO₄²⁻=PbSO₄
正极( B板):PbO₂+4H⁺+SO₄²⁻+2e=PbSO₄+2H₂O
放电时两极上的反应恰为充电时两极反应的逆反应。总的电池反应为:
放电时正极和负极都变成PbSO₄,同时随着放电时H₂SO₄的消耗,溶液的比重降低。当溶液比重降到大约1.05或每对电极间电压下降到1.7伏(此数值随不同的放电情况以及电池的型号而略有不同)左右时,就应停止使用,需重新充电。蓄电池的电压高,放电情况稳定,电能的输出效率较高;但缺点是较笨重,保养要求严格,如果长期不用或长期不充电,蓄电池就会被损坏。
把几组电池串联,就可获得较高的电压,市售的铅蓄电池有6伏、12伏和24伏等多种规格。