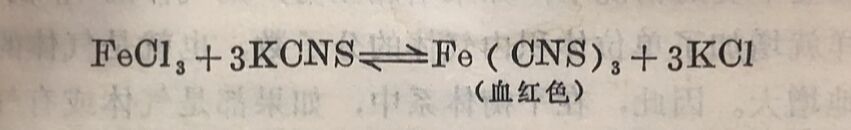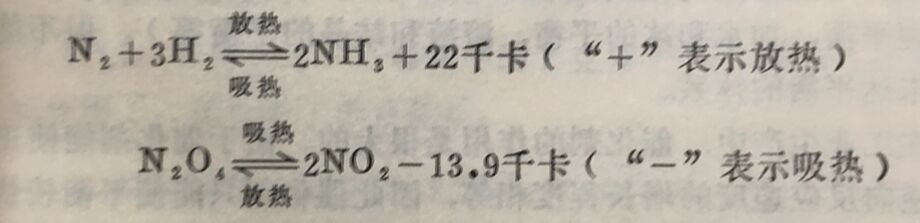平衡时,正反应速度和逆反应速度相等。在温度不变的情况下,如果在此已达平衡的溶液中加入KCNS饱和溶液,由于反应物浓度的增加,加快了正反应速度,使正反应速度暂时大于逆反应速度,平衡就被破坏,反应便向生成Fe(CNS)₃的方向进行,溶液的红色因而变深。随着反应的进行,正反应的速度又逐渐减小,同时由于生成物的浓度逐渐增大,逆反应的速度也相应增大,直至正、逆反应速度又相等时,反应就达到了新的平衡。这时四种 物质的浓度和原来平衡时各自的浓度都不相同了: FeCI的浓度 比原来的小,Fe(ONS)₃和KCI的浓度都比原来的大,平衡 向正反应方向移动。同样道理,如果降低生成物Fe(ONS)₃的浓度,或者降低KCNS和FeCl₃的浓度,平衡将向逆反应方向移动。
浓度对化学平衡的影响可归纳为:在其它条件不变时,增大反应物的浓度或者减少生成物的浓度,可以使平衡向着正反应(即向右)方向移动;增大生成物的浓度或者减少反应物的浓 度, 可以使平衡向着逆反应 (即向左 )的方向移动。
浓度的改变引起化学平衡移动的规律是很重要的。在生产中,常常采用增大反应物浓度或减少生成物浓度的办法,使反应尽可能地进行得更完全。例如为了尽可能让煤粉充分燃烧成二氧化碳,就必须加入过量的空气。又如,煅烧石灰石制造生石灰的反应:
CaCO₃(固)⇔CaO(固) + CO₂↑
由于生成的CO₂气体不断地从窑炉排出,所以这个反应可以趋向完全。
二、压力对化学平衡的影响
在温度不变的情况下,如果增加压力,则气体的体积要缩小,这样就增加了单位体积内气体的分子数,也就是气体的浓度也相应地增大。因此,在平衡体系中,如果都是气体或有气体参加的反应,压力对平衡的影响,实质上和浓度对平衡的影响相同。例如,在常温下,NO₂气体(红棕色)聚合成N₂O₄气体(无色)的反应:
2NO₂⇔N₂O₄
在平衡时,v正=v逆。当温度不变时,如果将气体的总压力增加一倍,则气体体积缩小到原来的½,而各气体的浓度将增加 到原来的2倍,根据质量作用定律表达式: v正=k正[NO₂]²及v逆=k逆[N₂O₄]。可以看出,这时v正增加到原来的四倍,而v逆增加到原来的2倍。由于v正>v逆,平衡就被破坏,平衡向着生成N₂O₄的方向移动,因此混合气体的颜色变浅。如果我们将气体的总压力降低到原来的½,则气体的体积将增大到原来的2倍,而气体的浓度将为原来的½,这时v正减小到原来的¼,而v逆减小到原来的½。由于v逆>v正,平衡向着生成NO₂的方向移动,因此混合气体的颜色变深。由此可见,反应物和生成物的气体分子数不同时,压力对正、逆反应速度的影响是不同的。
压力对平衡的影响可归纳为:当其它条件不变时,增大压力使平衡向气体分子数减少的方向移动;减小压力,使平衡向气体分子数增多的方向移动。显然,如果气体分子反应前后的总数相等时,压力改变对平衡没有影响。例如:
CO(气)+ H₂O(气)⇔C₂O(气)+H₂(气)
H₂(气)+I₂(气)⇔2HI(气)
这些反应中,反应物的气体分子数和生成物的相等,所以压力对平衡无影响。
压力对于固态或液态物质的体积影响非常小。因此在讨论压力对不均匀体系平衡的影响时,只考虑参加反应气态物质的分子数。例如:
CO₂(气)+C(固)⇔2CO(气)
增加压力使平衡向气体分子数减少的一方,即向生成CO₂的方向移动。
三、温度对化学平衡的影响
化学反应进行时,往往伴随有放热或吸热,这个现象叫做反应的热效应。放出热量的反应叫放热反应,吸收热量的反应叫吸热反应。对于同一可逆反应来说,如果正反应是放热的,那么逆反应就是吸热的;反之,如果正反应是吸热的,那么道反应就是放热的,而且放出的热量和吸收的热量应相等,例如,
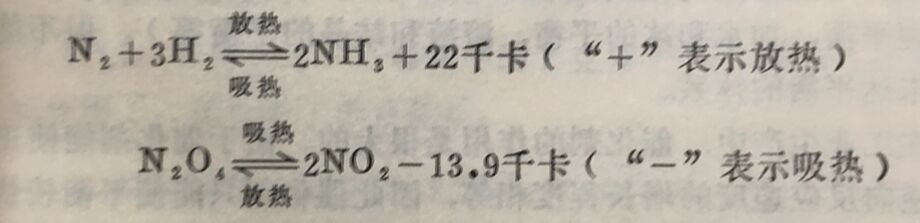
这种标有热量变化的化学反应方程式,叫热化学方程式。当可逆反应达到平衡以后,如改变温度,则正、逆两反应的速度都要改变,但是两者改变的倍数不相同。这样v正就不再等于v逆,因而平衡被破坏。如可逆反应的正反应为放热反应,就表示逆反应的活化能比正反应的活化能大(见图5-2)。前面已谈到活化能愈大,温度增加时反应速度增加得愈快,或者说速度常数k增加的倍数愈大。这样升高温度时,平衡就向逆反应方向(吸热方向)移动。反之,如正反应为吸热反应,则正反应的活化能比逆反应的活化能大;升高温度时,平衡就向正反应方向(放热方向)移动。由此可以得出一个结论:温度升高,平衡向着吸热反应的方向移动;降低温度,平衡向着放热反应的方向移动。因此,把盛有NO₂和N₂O₄的平衡混合物的容器放在热水中时,则平衡向生成NO₂的方向移动,所以混合气体颜色变深;如果把此容器放在冰水中 时,则平衡向生成N₂O₄的方向移动,因此混合气体的颜色变淡。
虽然浓度、压力和温度都能使平衡发生移动,但温度的影响和浓度、压力的影响有所不同。浓度和压力并不改变平衡常数,而温度却能使平衡常数发生改变,因此在谈到平衡常数时,必须指明温度。
从以上讨论可知,如果增加平衡体系中反应物的浓度,平衡就向生成物的方向移动,也就是向减小反应物浓度的方向移动;如果升高压力,平衡就向减少气体分子数的方向移动,即向减小压力的方向移动;如果升高温度,平衡就向吸热方向,也就是向降低温度的方向移动。
以上结论可用一条普遍规律来表示,如果改变平衡体系条件(浓度、压力和温度)之一,平衡就向削弱这个改变的方向移动。这个规律叫做吕.查德里原则。它适用于所有的动态平衡(包括物理平衡,如水和冰的平衡,溶液和结晶的平衡等),但不能用于未达平衡的体系。
在工业生产中,催化剂的作用是很大的。由于催化剂能使正向和逆向反应速度的增长程度相等,因此催化剂只能使平衡较快地达到,但不能使平衡移动。故在.定压力和温度下,无论用不用催化剂,最大的转化率是一样的。但催化剂可以缩短反应达到平衡的时间,例如:
SO₂+½O₂⇔SO₃+22.9千卡
要想提高这一反应的转化率,根据平衡移动的原理,可以用降低温度的方法来实现。但是温度过低,SO₂的转化反应速度太慢,衢要较长的时间才能达到平衡。如用V₂O₆作催化剂,就可在温度较低的条件下,很短时间内达到平衡。