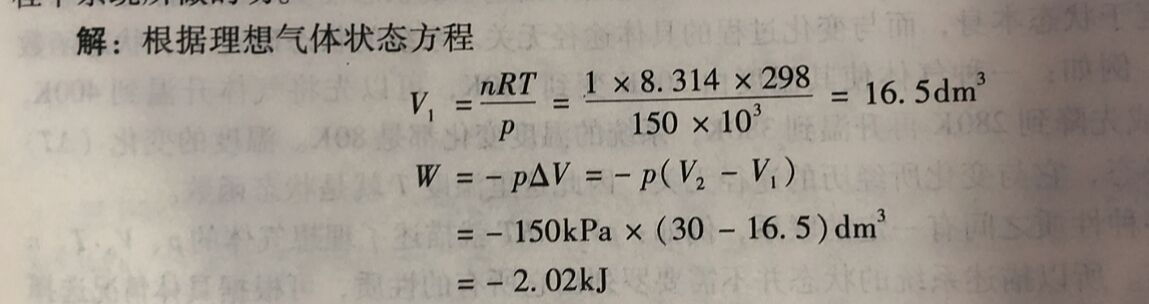化学反应中的能量关系
铜臭 / 2022-07-11
1.2.1基本概念
1.2.1.1系统与环境
在研究问题时,首先要确定研究对象的范围和界限。热力学把被研究的对象称为系统,系统以外与系统密切相联系的部分称为环境。系统与环境的确定是根据研究的需要人为划分的。例如,研究硝酸银与氧化镇在水溶液中的反应。把这两种溶液放在小烧杯中,那么溶液就是一个系统,而溶液之外的与之有关的其他部分(烧杯、溶液上方的空气等)统和环境之间物质和能量的交换情况,将系统分为以下三种:
(1)敞开系统:系统与环境之间既有物质交换又有能量交换。
(2)封闭系统:系统与环境之间只有能量交换而没有物质交换。
(3)孤立系统:系统与环境之间既没有物质交换也没有能量交换。
应当指出,真正意义上的孤立系统是不存在的,热力学中有时会把系统和与系统有密切联系的环境部分合并在一起当作孤立系统。
系统中任何 具有相同的物理和化学性质的部分称为相。例如对于冰水混合物来说,水溶液是一个相,称为液相;冰是一个相,称为固相;溶液上面的气体也是一个相,称为气相。相与相之间有明显的界面存在,但系统与环境之间可能有界面,也可能没有界面。化学反应分为均 相反应和多相反应。仅在单一的相中发生的反应称 为均相反应:在相与相的交界面上发生的反应则称为多相反应。
1.2.1.2状态和状态 函数
热力学用系统的性质来确定系统的状态,也就是说系统的性质(如温度、压力、体积、质量等)总和决定了系统的状态。系统的性质一定时,系统的状态也就确定了。若系统中某性质改变了,系统的状态也就必然改变,通常就把这些用来描述系统状态性质的函数称为状态函数。状态函数决定于状态本身,而与变化过程的具体途径无关。系统的状态确定了,状态函数就有一定的数值。例如:一种气体使其温度由300变到380K,可以先将气体升温到400K,然后降到380K;或先降到280K再升温到380K,系统的温度变化都是80K。温度的变化(ΔT)只决定于始态和终态,它与变化所经历的途径无关,因此这里温度T就是状态函数。
由于系统的多种性质之间有一定的联系, 例如: pV=nRT就描述了理想气体的p、V、T、n四个量之间的关系。所以描述系统的状态并不需要罗列出它所有的性质,可根据具体情况选择必要的能确定系统状态的几个性质就可以了。
状态函数按照其性质可以分为两类:
(1)广度性质:如果将系统分割成若干部分,系统的某些性质等于各部分该性质之和,也就是说有些状态函数的值与系统中物质的量的多少有关。体积、质量和热容等都是广度性质。例如某系统的体积为2dm³,它等于系统各部分的体积之和。
(2)强度性质:状态函数的值与系统中物质的量的多少无美,只与系统本身的性质有关,温度和压力都是强度性质,例如两杯298K的水混合后还是298K。
系统状态发生变化的经过称为过程。在系统状态变化的过程中如果系统的温度保持不变,则称力恒温过程:如果系统的压力保持不变,则称力恒压过程:如果系统的体积保持不变,则称为恒容过程。
1.2.1.3 内能、热和功
内能是系统内部能量的总和(又称热力学值),用符号U表示,单位为J/mol (或 k/mol)。包括系统内物质的分子或原子的振动能、转动能、 平动能和核能等。内能仅取决于 系统的状态,系统的状态一定, 内能就有确定的值,也就是说内能是系统的状态函数。系统的状态发生变化时,只要始态、终态确定,内能的变化量就是一定的。
系统内部名质点的运动和相互作用是很复杂的。所以内能的绝对值目前还无法测定,但系统的状态变化时,内能的变化量是可以测定的。内能的变化量可由变化过程中系统和环境所交换的热和功的数值来确定。
热和功是系统的状态变化时与环境交换能量的两种不同形式。热是由于温度的不同,在系统与环境之间交换的能量,用符号Q表示。通常规定:系统从环境吸收热量Q为正值,系统放出热量Q为负值。系统与环境之间除了热以外,以其他形武交换的能量统称为功,用符号W表示。并规定:系统对环境做功W为负值,环境对系统做功W为正值。
由热和功的定义可知,热和功总是和系统的变化联系着,系统的状态没有变化,系统与环境之间就没有能量交换,也就没有热和功,因此,热和功与内能不同,它们不是状态函数。不能说某系统含有多少热或者多少功,但是可以说某系统在变化过程中吸收或放出多少热,做了多少功。
功有多种形式,可分为体积功和非体积功。体积功是指系统与环境之间因体积变化所做的功;非体积功是指除体积功之外,系统与环境之间以其他形式所做的功,非体积功通常包括电功等。体积功对于化学过程来说有特殊的意义,许多化学反应都是在敞口的容器中进行,如果外压p保持不变,这时系统所做的体积功为
W=-pΔV=-p(V₁-V₂)
当系统对环境做功,体积膨胀,功为负:环境对系统做功,体积减小,功为正。本章只讨论体积功。
例1-3 Iumo 理想气体在298K,150kPa条件下,恒压变化至体积为30.0dm³计算这一过程中系统所做的功。
1.2.2热力学第一定律
热力学第一定律的内容就是能最守恒定律,其文字叙述如下:自然界一切物质都具有能量,能量有不同的表现形式,可以从一种形式转化为另种形式, 也可以从一个物体传递给另一个物体,在转和传递过程中能量的总和不变。
假设有一封闭系统,它的内能为U₁,该资系统从环境吸收热量Q,同时环境对系统做了W的功,结果使这个系统从内能为U₁的始态变为内能为U₂的终态。根据能量守恒定律或
U₂=U₁ +Q+W
ΔU=Q+W
式(1-4)即为热力学第一定律的数学表达式,即系统内能的变化等于系统从环境吸收的热量加上环境对系统做的功。
当压力不变, 只做体积功的条件下,热力学第一定律可以表示为
ΔU = Q-pΔV
例1-4 系统在化学反应过程中, 吸收热量1000kJ对环境做功500kJ,计算该系统内能的变化值?
解:根据热力学第一定律知
ΔU=Q+W =1000kJ- 500kJ = 500kJ
例1-5 在100kPa及373K时,水的汽化热为40 6kJ/mol,计算该条件下1mol水完全汽化时系统内能的变化值。
解: 系统吸热Q=40. 6kJ/mol,系统所做的功等于水汽化时由于体积膨胀所做的体积功。 W= -pΔV =-nRT (忽略液态水的体积)。
由热力学第一定律知
ΔU =Q+W= Q-nRT
=1 x40.6-1 x8.31 x373x10⁻³= 37.5kJ