在电解质溶液中,离子与水,以及离子与离子相互间都有相互作用,并发生水合、水解、离子缔合和生成络合物等等的反应,溶液作为整体处于最稳定的状态,只要外部不施加任何作用,任何方向的反应也不会发生。一旦该状态的物理条件(温度,压力)改变,或有成分出入的条件下,体系就要转移到新的稳定状态。这样样的稳定状态叫平衡状态。

溶液内的平衡,在热力学上可以像混合气一样处理。首先,很稀的溶液,可看成是溶质之间完全没有作用的理想溶液。体系的内能U与压力P容积V,温度T以及各成分的克分子数ni之间的函数关系可以表示如下:
式中,Uo表示适当的标准状态的内能,由热力学第一定律有下式关系:
该体系中所含的成分,由于化学反应相互转换,在这个情况下,U是化学形式1)浓度的函数。所以构成下式:由此,处于平衡的封闭体系则成下式:
式中,应用按下式定义的函数,即热焓,赫氏函数及吉氏函数:
1)认为包括可逆的电化学反应中的电子。
所以得出下边的关系式:
式中,μ0i是i成分为纯物质的化学位,R是气体常数,T是绝对温度。
在实际溶液的情况下,如适当地选择表示成分的方法也能用同样的函数形式表示。为此,新的的表示方法用活度
所以整个自由能的变化如下:
如把1个克分子的电解解质Cv+Av-溶于水中,随着Cv+Av-→v+C+v-A的变化,它就解离成为v+个克离子的阳离子与v-个克离子阴离子,其活度分别为a+和a-。因为溶液通常是电中性的,所以不能各自地求出这两个活度,只能一起得到该二个活度的合值,即求得电解质活度a为:
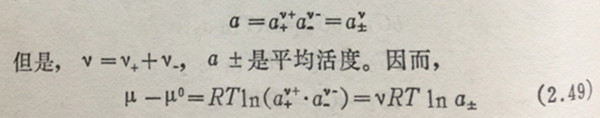
活度随温度、压力力的变化,与导出(2.47)和(2.48)式相同,可得:
为了使根据(2.42)式的化学位的活度定义更臻于完整,因而必须把μ0i的值决定下来,所以应该事先决定μ0值。参考体系要选的得当,在处理电解质溶液时,根据非对称参考体系表示化学位,这就是(1)作为溶剂在1个大气压下,把纯粹状态的活度作为1;(2)作为溶质,在1个大气压下,取无限稀释时活度等于克分子浓度。换言之,无限稀释时活度系数定为1。此外,下述述的基准也被决定下来。(3)在1个大气压下,与溶液平衡的固相,在各温度下以最稳定的结晶形的纯固体活度作为1。(4)气体的活度等于它的分压。
表示出实际溶液与理想溶液究竟有多大偏离是方便的,于是作为这种尺度用(2.50)式定义一个活度系数:
实际上重量克分子浓度m(molality,即1000克溶剂中溶质的克分子数)与体积克分子浓度c(molarity,即1000毫升溶液中溶质的克分子数)要比克分子分数N广为使用,所以与此对应的活度系数,可用下式表示:
活度,活度系数随浓度表示方法的不同而不同。这三个活度系数之间存在下列关系: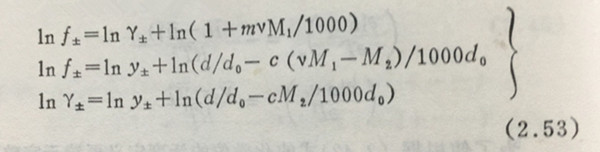
式中,M1是溶剂的分子量,M2是溶质的分子量,do,d分别是溶剂和溶液的密度。在理论上经常用f±,实用方面经常用Y±,在稀溶液中,f±=Y±=y±。