在常温下氢的化学性质是较不活泼的,但在加热时它能参加许多化学反应。
1.同氧的反应 点燃氢和氧的混合物时发生了一种剧烈的反应,生成了水。
2H2+O2→2H2O+热
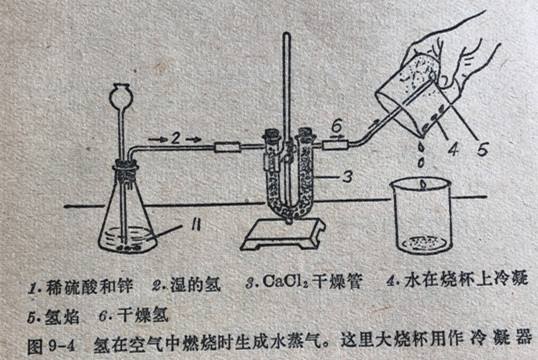
由于反应很激烈往往号引起爆炸。因此在处理氢气(或任何其它可燃性气体)时必须极为小心。在某些条件下氢可以燃烧而不发生爆炸。氢在空气或氧气中燃烧时生成水,这个事实可以使氢气流在一只倒置的冷且干燥的烧杯中燃烧(图9-4)来加以证明。
氢在纯氧中有很高的燃烧热,使用氢氧吹管有可能达到2800°的高温。这种吹管的热焰能够用来“切割”许多金属的厚板。
当双原子分子组成的氢气通过电弧时,氢吸收了能量使双原子分子分解为单原子的氢。
H2+热→2H
氢的单个原子彼此互相碰撞时容易重新结合起来,同时释放出分子在电弧中被分解时所吸收的热。
2H→H2+热
在这个反应中释放出的能量,加上氢在纯氧中燃烧释放出的能量被用作原子氢焰中(图9-5)。这种火焰用于切割和焊接熔点高达5000°的金属。
2.同氣以外的非金属反应 在适当的条件下氢同氧以外的一些非金属直接化合形成共价化合物。

H2+F2→2HF(氯化氢)
H2+C12→2HC1(氯化氢)
H2+Br2→2HBr(溴化氢)
H2+I2→2HI(碘化氢)
H2+S→H2S(硫化氢)
3H2+N2→2NH3(氨)
3.同某些金属的反应 氢也同一些活泼金属反应生成晶状的离子型氢化物。在这些化合物中氢成为阴离子H-。
2Li+H2→2LiH(氢化锂) Ca+H2→CaH2(氢化钙)
反应是放热的,所得到的氢化物对热是较稳定的,但同水剧烈反应。
4.同化合物的反应 氢同许多金属氧化物在加热的情况下反应,生成单质金属和水。举例来说,当将氢气通过加热的氧化铜(II)时生成铜和水。
Cuo+H2→Cu+H2o
这是氧化一还原反应的一个例子。这里,氢从氧化铜中取代了氧,所发生的化学变化叫做还原。氢分子起着还原剂的作用,毎一个原子失去一个电子,因此它被氧化。氧化铜(II)中的氧从氢取得电子,因而使氢被氧化,所以氧化铜(II)是氧化
剂。还原过程和氧化过程总是同时发生的。
氢也可以同某些金属氧化物反应,使它们还原成较低的氧化物。
Mno+h2→Mno+H2O