
















氧气可以从空气或某些含氧化合物来制备。因为空气和水很丰饶,容易获得而且成本低廉,同时它们的利用过程又很简单,因此几乎所有的工业氧都是从这两种来源得到的。大约有97%的氧是从空气生产的,而3%的氧是由电解水生产的。1974年氧的总产量共达16×10°吨,在所有化学品的生产中占第三位。全部生产的氧约有70%主要用于钢铁工业,使用过程将在后面再行介绍。
1.由液态空气的分蚁接发来制备 工业用量的氧是从空气制得的,首先将空气冷冻和压缩到使它液化,然后把低沸点的氮气和一些其他成分蒸发出去(见第24.2节和第25.2节)。可以把氧以液体状态存放在不同规格的杜瓦( Dewar)瓶中(见图24-2)。这些杜瓦瓶可以通过部分氧的蒸发而能自发冷冻。不过更大量的工业氧则是以压缩气体的形式装在钢瓶中贮存和运输的。液态氧是现代火箭推进剂的组成之一。
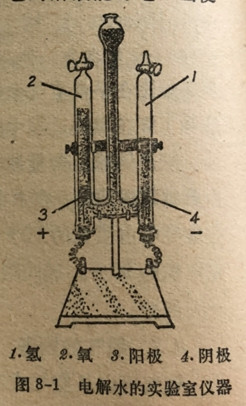 2.由水的电解来制备 纯水是电的一种极不良导体;但是将少量的酸、碱或盐溶于水中时所得到的溶液就容易传导电流。酸、碱和盐是三种重要的化合物,叫做电解质,它的溶液能导电。当使电流通过一种电解质溶液时,电解质的离子就是传送电流的载体;离子向着两个电极移动,正离子(阳离子)向负极(阴极)移动,而负离子(阴离子)向正极(阳极)移动。这种过程叫做电解(见第22章)。当使电流通过含有少量电解质如H2SO4,NaOH或Na2SO4的水时,在阴极上就生成氢气的气泡而氧则在阳极上逸出(图8-1)。所产生氢气的体积是氧气体积的2倍。净反应可归纳为如下方程式:
2.由水的电解来制备 纯水是电的一种极不良导体;但是将少量的酸、碱或盐溶于水中时所得到的溶液就容易传导电流。酸、碱和盐是三种重要的化合物,叫做电解质,它的溶液能导电。当使电流通过一种电解质溶液时,电解质的离子就是传送电流的载体;离子向着两个电极移动,正离子(阳离子)向负极(阴极)移动,而负离子(阴离子)向正极(阳极)移动。这种过程叫做电解(见第22章)。当使电流通过含有少量电解质如H2SO4,NaOH或Na2SO4的水时,在阴极上就生成氢气的气泡而氧则在阳极上逸出(图8-1)。所产生氢气的体积是氧气体积的2倍。净反应可归纳为如下方程式:
2H2O+电能→2H2↑+O2↑
必须记住这个方程式仅仅指出生成了什么产物;它并没有指明反应机理。实际上,有如我们将在第22.5节中可以看到在电极上发生的反应要比这筒单方程式所指明的复杂得多。由于电能的高成本,利用电解来工业生产氧气受到了限制。在这个反应中涉及到要用以电能形式的能量,因因此重要的一点是应注意如果使电解产生的氢气和氧气进行燃烧而再化合生成水时,过程中将以热和光的形式放出同样数量的能量。
.jpg) 3.由金属氧化物的加热来制备 汞、银、金和铂的氧化物在加热时就失去氧。举例来说,给红色氧化汞(II)加热时(图8-2)生成了金属汞和氧。
3.由金属氧化物的加热来制备 汞、银、金和铂的氧化物在加热时就失去氧。举例来说,给红色氧化汞(II)加热时(图8-2)生成了金属汞和氧。
2HgO[氧化汞(II)]+△→2Hg+O2
这就是普利斯特菜和拉瓦锡制备氧气时所用的方法。把它应用在工业上就太昂贵了,它仅在历史意义上是重要的。对于氧化银Ag2O,氧化金如Au2O和Au2O3以及氧化铂如PtO和PtO2来说可以写出与氧化汞(I)热分解相类似的方程式。
在给某些金属氧化物加热时,仅能放出一部分氧:
2BaO2(过氧化钡)+△→2BaO(氧化钡)+02
4.由某些含氧盐的加热来制备 某些金属的硝酸盐在加热时能产生氧气:
2NaNO3(硝酸钠)+△→2NANO2(亚硝酸钠)+O2
2Cu(NO3)2[硝酸铜(II)]+△→2Cu0[氧化铜(II)]+4NO2(二氧化氮)+O2
在实验室中以小量制备氧气的常用方法是把氯酸钾加热到比它的熔点368.4°0约高50(图8-3)。应当注意的是,在给硝酸钠加热时只放出一部分氧,而在给氯酸钾加热时全部的氧都能放出来。如果用二氧化锰同氯酸盐混合起来,后者在大约
.jpg)
270°C时就能非常迅速地分解了,这比它的熔点差不多低了100°C。
2KC1O3(氯酸钾)+△→MNO2→2KC1(氯化钾)+3O2
反应完成后可以把二氧化锰无变化地回收;它的作用仅在于“催化”该反应使反应可以在较低温度下快速地进行。许多其他金属氧化物,例如Fe2O和Cr2O3也可以用作氯酸酸钾分解的催化剂。催化剂是一种能改変反应速度而它本身不发生持久化学变化的物质。催化剂在它们的作用中往往是特效的;能催化某一反应的物物质往往对另一反应是无效的。
给氯酸钾加热来制备氧时不小心从事可能是很危险的。把可燃性物质如碳、硫橡皮或点燃的木片同熔化(熔融)的氯酸钾相接触时能够发生爆炸。在此实验中的危险性是不能忽视的。用这方法制备氧时应当小心。
5.用水作用于过氧化钠来制备 一个方便但昂贵的制备氧气的方法是用水作用于过氧化钠。过氧化钠钠是在过量的氧气或空气中燃烧钠而生成的一种白色固体。
2NA202(过氧化钠)+2h20→[4NA++4oh(氢氧化钠)]-+02↑
氢氧化钠在水溶液中是以独立的离子存在的,这一事实使我们用Na++OH-来标志它,而不用化学式NaOH。把溶液蒸发
至干酒将会使离子结合在一起而形成固态的氢氧化钠(往往写成NaOH)。